2 F + Ca2+ CaF2
3. Bárium-klorid-oldat. Fehér, kocsonyás bárium-fluorid-csapadék keletkezik, oldhatósági szorzat:
L(BaF2, 25 C) = 1,84∙107:
2 F + Ba2+ BaF2
4. Koncentrált kénsav. Ha szilárd fluoridot koncentrált kénsavval melegítünk, színtelen, korrozív gáz, hidrogén-fluorid (H2F2) keletkezik, ami megtámadja a kémcső anyagát, és a kémcső olyan lesz, mintha zsíros lenne. A kénsav nem nedvesíti a kémcső falát, hanem lepereg róla. A hidrogén-fluorid szilícium-tetrafluoridot (SiF4) tesz szabaddá, ami a jelenlevő vízzel azonnal elhidrolizál, és így egy kocsonyás „metaszilíciumsav” [H2SiO3 (SiO2∙H2O)] keletkezik az üveg felületén.
2 F + H2SO4 H2F2 + SO4 2 SiO2 + 2 H2F2 SiF4 + 2 H2O
3 SiF4 + 3 H2O 2 [SiF6]2 + H2SiO3 + 4 H+
3.7.2. Kloridionok jellemző reakciói, Cl– A legtöbb szervetlen klorid oldódik vízben.
A higany(I)-klorid Hg2Cl2, ezüst-klorid AgCl, ólom-klorid PbCl2, réz(I)-klorid CuCl, bizmut- oxiklorid BiOCl, antimon-oxiklorid SbOCl, valamint higany(II)-oxiklorid HgCl2∙HgO, nem oldódik vízben. (A PbCl2 viszonylag jól oldódik forró vízben.)
Például Vegyület Oldhatóság (g/100 ml víz)
20 C-on: AgCl
PbCl2
Hg2Cl2
0,00016 0,98 0,00023
20 C-on: HgCl2
LiCl
6,6 82,0
A kloridionok jellemző reakcióinak tanulmányozásához használjon 0,1 M nátrium-klorid- (NaCl-) -oldatot.
1. Ezüst-nitrát-oldat. Fehér, túrós ezüst-klorid-csapadék keletkezik. Oldhatósági szorzat: L(AgCl, 25 C) = 1,77∙1010:
Cl + Ag+ AgCl
A csapadék oldhatatlan vízben és híg salétromsavban, de hidegen oldódik híg ammóniaoldatban, koncentrált ammónium-karbonát-oldatban, kálium-cianid-oldatban és nátrium-tioszulfát-oldatban. A csapadék melegítésre már 2 M ammónium-karbonát-oldatban is oldódik.
AgCl + 2 NH3 Ag(NH3)2+ + Cl
AgCl + (NH4)2CO3 Ag(NH3)2+ + Cl + CO2 + H2O AgCl + 2 Na2S2O3 4 Na+ + [Ag(S2O3)2]3 + Cl
AgCl + 2 KCN 2 K+ + [Ag(CN)2] + Cl
3.7.2.1. videó: Ezüst-nitrát reakciója nátrium-kloriddal
2. Ólom-acetát-oldat. Töményebb, hideg oldatból fehér ólom-klorid-csapadék válik ki. A csapadék oldódik forró vízben, majd az oldatot lehűtve újra kiválik. Oldhatósági szorzat: L(PbCl2, 25 C) = 1,17∙105:
Pb2+ + 2 Cl PbCl2
3. Koncentrált kénsav. A kénsav a kloridot nem oxidálja, csupán sósav fejlődik az oldatból:
Cl + H2SO4 HCl + HSO4
4. Mangán-dioxid és koncentrált kénsav. Klórgáz fejlődik, ha fém-kloridot mangán-dioxiddal összekeverünk, majd koncentrált kénsavat öntünk rá, és enyhén melegítjük. A klórgáz azonosít- ható a szaga, sárgászöld színe, valamint az alapján, hogy a nedves lakmuszpapírt megfehéríti, illetve a kálium-jodidos és keményítős szűrőpapírt megkékíti.
2 Cl + MnO2 + 2 H2SO4 Mn2+ + Cl2 + 2 SO42 + 2 H2O 5. Kálium-dikromát és koncentrált kénsav (kromil-klorid teszt)
3.7.2.1. ábra: Kromil-klorid teszt
Ha egy szilárd kloridot összekeverünk háromszoros mennyiségű (tömegű) elporított kálium-dikro- máttal egy kémcsőben, majd ugyanolyan térfogatú koncentrált kénsavat adunk a keverékhez és enyhén melegítjük, vörös színű kromil-klorid-, CrO2Cl2-gőzök fejlődnek, melyek átdesztillálhatók a nátrium- hidroxid-oldatba (3.7.2.1. ábra). A kromil-klorid illékony folyadék (fp. 116,5 °C), ami elreagál
nátrium-hidroxiddal nátrium-kromát keletkezése közben, és az oldat megsárgul. A kromát keletkezése kimutatható úgy, hogy a nátrium-hidroxidos oldatot megsavanyítjuk kénsavval, majd 1-2 ml amilalkoholt, végül kevés hidrogén-peroxidot adunk hozzá. A szerves fázis megkékül CrO5 kelet- kezése következtében.
4 Cl + Cr2O7
2 + 6 H+ 2 CrO2Cl2 + 3 H2O CrO2Cl2 + 4 OH CrO4
2 + 2 Cl + 2 H2O
Bromidokból és jodidokból a szabad halogén (Br2 és I2) keletkezik, mely a nátrium-hidroxiddal színtelen ion keletkezése közben reagál.
A reakciót kisebb mennyiségű anyaggal is elvégezhetjük. Kisméretű porcelántégelyben keverjünk alaposan össze néhány cg kálium-kloridot, kálium-bikromátot és kevés tömény kénsavat, majd fedjük le a tégelyt egy óraüveggel. Óvatos melegítés hatására az óraüvegen először a kénsav víztartalma csapódik le, majd a reakcióban képződő vörös színű, a reakcióelegyből kidesztillálódó kromil-klorid.
Ez a vízcseppben hidrolizál, és narancssárga cseppecskék keletkeznek:
2 CrO2Cl2 + 3 H2O → Cr2O7
2– + 4 Cl– + 6 H+
Ha ezután az óraüveget óvatosan leemeljük a tégelyről, egy gyors mozdulattal megfordítjuk, és a na- rancssárga cseppekhez egy csepp 2 M nátrium-hidroxidot cseppentünk, a cseppek színe citromsárgára változik. Ezután egy csepp ólom-nitrát oldat hatására leválik a sárga színű ólom-kromát- csapadék.
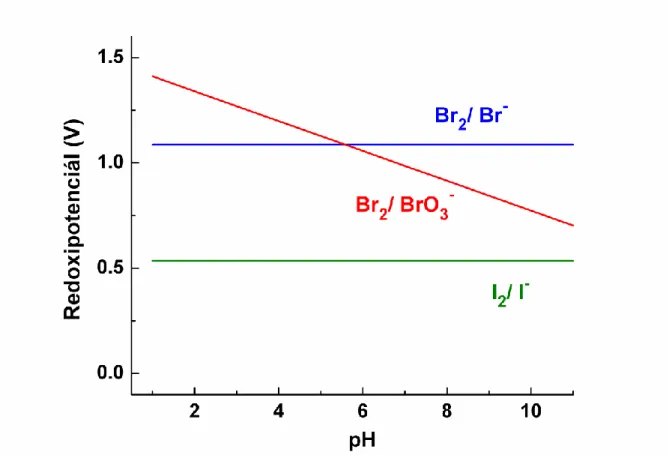
6. Berg-próba: Cl-ion kimutatása Br és I mellett.
A Berg-próba során a bromidot és a jodidot színtelen monobróm-, illetve monojód-acetonná alakítjuk, mely nem zavarja a kloridion ezüst-nitráttal történő kimutatását (lásd 3.7.2.2. ábra):
3.7.2.2. ábra: redoxipotenciálok összehasonlítása és pH függése
HBrO3 + 5 HBr 3 Br2 + 3 H2O 2 HBrO3 + 10 HI 5 I2 + 2 HBr + 6 H2O
(CH3)2CO + Br2 CH3COCH2Br + HBr (CH3)2CO + I2 CH3COCH2I + HI Cl + AgNO3 AgCl + NO3
Adjon 0,5-1,0 ml Cl-, Br- és I-ionokat tartalmazó oldathoz 20 ml 2M H2SO4-oldatot és 5 ml acetont, majd csepegtessen az elegyhez annyi 1%-os KBrO3-oldatot, hogy az átmenetileg keletkező barna színeződés a további csepegtetésre ne álljon elő. Ezután adjon az oldathoz 2 M HNO3- és AgNO3-oldatot. (Ügyeljen arra, hogy ne adjon KBrO3-oldatot túlzott feleslegben, mert AgBrO3- csapadék válhat le. Ez utóbbi azonban 2 M HNO3-ban feloldódik.)
3.7.3. Bromidionok jellemző reakciói, Br–
Az ezüst-, higany(I)- és réz(I)-bromid vízben oldhatatlan. Az ólom-bromid rosszul oldódik hideg vízben, de viszonylag jól oldódik forró vízben.
A legtöbb bromid, a fentieket kivéve oldódik vízben.
Például Vegyület Oldhatóság (g/100 ml víz)
0 C-on 100 C-on AgBr
PbBr2
– 0,00037 0,4554 4,71 KBr 53,48 102
A bromidionok jellemző reakcióinak tanulmányozásához használjon 0,1 M nátrium-bromid- (NaBr-) -oldatot.
1. Ezüst-nitrát-oldat. Halványsárga ezüst-bromid-csapadék keletkezik. Oldhatósági szorzat:
L(AgBr, 25 C) = 5,35∙1013:
Br + Ag+ AgBr
A csapadék rosszul oldódik híg, de jól oldódik koncentrált ammóniaoldatban. A csapadék oldódik kálium-cianid- és nátrium-tioszulfát-oldatban is, de nem oldódik híg salétromsavban.
AgBr + 2 NH3 Ag(NH3)2+ + Br AgBr + 2 Na2S2O3 4 Na+ + [Ag(S2O3)2]3 + Br
AgBr + 2 KCN 2 K+ + [Ag(CN)2] + Br
3.7.3.1. videó: Ezüst-nitrát reakciója kálium-bromiddal
2. Ólom-acetát oldat. Fehér, kristályos ólom-bromid-csapadék keletkezik. Oldhatósági szorzat:
L(PbBr2, 25 C) = 6,60∙106:
2 Br + Pb2+ PbBr2
A csapadék oldódik forró vízben, de az oldat lehűlésekor újra kikristályosodik.
3. Koncentrált kénsav. Először vörösesbarna oldat keletkezik, majd vörösesbarna gőzök jelennek meg, melyek brómot és hidrogén-bromidot tartalmaznak:
Br + H2SO4 HBr + HSO4 2 Br + 2 H2SO4 Br2 + SO2 + SO4
2 + 2 H2O
3.7.3.2. videó: Kálium-bromid reakciója tömény kénsavval
4. Mangán-dioxid és koncentrált kénsav. Vörösesbarna brómgőzök keletkeznek. A bróm könnyen felismerhető jellemző színéről és szagáról.
2 Br + MnO2 + 2 H2SO4 Br2 + Mn2+ + 2 SO4
2 + 2 H2O
5. Klóros-víz. Ha a reagenst cseppenként hozzáadjuk a bromidion tartalmú oldathoz, bróm kelet- kezik, amely az oldatot narancsosvörösre színezi; ha szén-tetrakloridot adunk hozzá és össze- rázzuk, a bróm átmegy a szerves fázisba, és rövid állás után alul vörösesbarna szerves és felül színtelen vizes fázis keletkezik.
Feleslegben vett klóros vízzel a bróm átalakul sárga bróm-monokloriddá (vagy részben színtelen hipobrómossavvá) és halványsárga oldat keletkezik (különbség a jodidtól, mely klóros víz feleslegével színtelen oldatot ad).
2 Br + Cl2 Br2 + 2 Cl Br2 + Cl2 2 BrCl
6. Salétromsav. A forró, töményebb (1 : 1) salétromsav a bromidot brómmá oxidálja:
6 Br + 8 HNO3 3 Br2 + 2 NO + 6 NO3 + 4 H2O
7. Kálium-dikromát és kénsav. Ha bromid, tömény kénsav és kálium-dikromát keverékét óvatosan melegítjük, és a fejlődő gőzöket vízbe vezetjük, sárgásbarna oldatot kapunk a keletkező bróm miatt. Ha az oldathoz nátrium-hidroxidot adunk, elszíntelenedik. (Kromil-bromid a reakcióban nem keletkezik, így a vizes oldat, illetve a nátrium-hidroxidos oldat kromátot nem tartalmaz. Nem adja a peroxo-krómsavas reakciót. Ez eltérést jelent a kloridoktól.)
6 Br + Cr2O7
2 + 7 H2SO4 3 Br2 + 2 Cr3+ + 7 SO4
2 + 7 H2O 3.7.4. Jodidionok jellemző reakciói, I–
Az ezüst-, higany(I)-, higany(II)- és réz(I)-jodidok vízben oldhatatlanok. Az ólom-jodid igen rosszul oldódik hideg vízben, és a forró vízben való oldhatósága is rossz.
A fontosabb jodidok, a fentieket kivéve, oldódnak vízben.
Például Vegyület Oldhatóság (g/100 ml víz) 20 C-on 100 C-on AgI
PbI2
– – 0,063 0,41 CaI2 209 426
A jodidionok jellemző reakcióinak tanulmányozásához használjon 0,1 M kálium-jodid (KI) oldatot.
1. Ezüst-nitrát oldat. Sárga, túrós ezüst-jodid-csapadék keletkezik, oldhatósági szorzat: L(AgI, 25 C) = 8,51∙1017. A csapadék jól oldódik kálium-cianid- és nátrium-tioszulfát-oldatban, kissé oldódik tömény ammóniaoldatban, de nem oldódik híg salétromsavban:
I + Ag+ AgI
AgI + 2 Na2S2O3 4 Na+ + Ag(S2O3)2]3 + I AgI + 2 KCN 2 K+ + Ag(CN)2] + I
3.7.4.1. videó: Ezüst-nitrát reakciója kálium-jodiddal
2. Ólom-acetát-oldat. Sárga ólom-jodid-csapadék keletkezik, oldhatósági szorzat: L(PbI2, 25 C) =
= 8,49∙109. Oldható nagyobb mennyiségű forró vízben színtelen oldat keletkezése közben, amelyből csillogó, aranysárga lemezek formájában kiválik, ha az oldat lehül (aranyeső próba):
2 I + Pb2+ PbI2
3. Tömény kénsav. Elemi jód keletkezik, ami melegítésre eltávozik az oldatból ibolyaszínű gőzök formájában, és a kémcső szájához tartott keményítőoldatos szűrőpapírt megkékíti. Az oldatból a jód szén-tetrakloriddal kiextrahálható, és a szerves fázist ibolyára színezi. A kénsav a jodidot oxidálja, miközben túlnyomórészt kén-dioxiddá redukálódik, de a sav töménységétől függően elemi kén is keletkezhet:
2 I + 2 H2SO4 I2 + SO4
2 + 2 H2O + SO2
3.7.4.2. videó: Kálium-jodid reakciója tömény kénsavval
4. Mangán-dioxid és tömény kénsav. Csak jód keletkezik, és a kénsav nem redukálódik:
2 I + MnO2 + 2 H2SO4 I2 + Mn2+ + 2 SO4
2 + 2 H2O
5. Klóros víz. Ha ezt a reagenst cseppenként adjuk a jodidoldathoz, jód keletkezik, ami az oldatot barnára színezi. A jód kiextrahálható szén-tetrakloriddal vagy kloroformmal, és a szerves fázist ibolyára színezi. Klóros víz feleslegének hozzáadására a jód színtelen jodáttá oxidálódik.
2 I + Cl2 I2 + 2 Cl
I2 + 5 Cl2 + 6 H2O 2 IO3 + 10 Cl + 12 H+ 6. Brómos víz. A jodidot jóddá oxidálja:
2 I + Br2 I2 + 2 Br
7. Kálium-dikromát és kénsav. Csak jód keletkezik (nem kromil-jodid), így nem keletkezik kromát ha a desztillátumot nátrium-hidroxid oldatba vezetjük. (Eltérés a kloridoktól.)
6 I + Cr2O72 + 7 H2SO4 3 I2 + 2 Cr3+ + 7 SO42 + 7 H2O
8. Nátrium-nitrit-oldat. Jód keletkezik, ha a reagenst jodidion tartalmú oldathoz adjuk, majd az oldatot megsavanyítjuk híg sósavval vagy kénsavval. (Eltérés a bromidoktól és jodidoktól.) A jód azonosítható szén-tetrakloridos kirázással vagy keményítőoldattal.
2 I + 2 NO2 + 4 H+ I2 + 2 NO + 2 H2O
3.7.4.3. videó: Kálium-nitrit reakciója kálium-jodiddal
9. Réz-szulfát-oldat. Barna csapadék keletkezik, ami réz(I)-jodid, CuI (oldhatósági szorzat: L(CuI, 25 C) = 1,27∙1012) és jód keveréke. A jód eltávolítható például nátrium-tioszulfát-oldattal, és így közel fehér réz(I)-jodid csapadék nyerhető:
4 I + 2 Cu2+ 2 CuI + I2 I2 + 2 S2O3
2 2 I + S4O6 2
3.7.4.4. videó: Réz(II)-szulfát reakciója kálium-jodiddal
10. Higany(II)-klorid-oldat. Vörös higany(II)-jodid-csapadék keletkezik, oldhatósági szorzat:
L(HgI2, 25 C) = 2,82∙1029:
2 I + HgCl2 HgI2 + 2 Cl
A csapadék oldódik kálium-jodid feleslegében, vízoldható tetrajodo-merkurát(II) komplex képződése közben:
HgI2 + 2 I HgI4]2
3.7.4.5. videó: Higany(II)-klorid reakciója kálium-jodiddal 11. Bizmut(III)-nitrát-oldat. Fekete bizmut(III)-jodid-csapadék keletkezik:
3 I + Bi3+ BiI3
A bizmut(III)-jodid-csapadék oldódik kálium-jodid feleslegében, narancssárga színű tetrajodo- bizmutát komplex ionok képződése közben:
BiI3 + I BiI4]
3.7.4.6. videó: Bizmut-nitrát reakciója kálium-jodiddal
12. Vas(III)-klorid oldat. Jodidok megsavanyított oldatából lassan, melegítésre gyorsabban, elemi jódot választ ki, mely keményítőoldattal, vagy szén-tetrakloriddal való kirázás alapján felismer- hető (eltérés a bromidionoktól):
2 I + 2 Fe3+ I2 + 2 Fe2+
13. Keményítőoldat. A jodidok könnyen oxidálhatók savas közegben elemi jóddá számos oxidálószerrel (pl. KIO3, K2Cr2O7, KMnO4, H2O2, KNO2). A keletkező jód mélykék színeződést ad keményítővel, így könnyen azonosítható. Az egyik legjobb oxidálószer a megsavanyított kálium-nitrit- oldat vagy a megsavanyított hidrogén-peroxid-oldat:
2 I + 2 NO2 + 4 H+ I2 + 2 NO + 2 H2O H2O2 + 2 I + 2 H+ I2 + 2 H2O 3.7.5. Klorátionok jellemző reakciói, ClO3
Valamennyi fontosabb szervetlen klorát oldódik vízben.
Például 20 C-on: Vegyület Oldhatóság (g/100 ml víz) NaClO3
KClO3
Ca(ClO3)2
Zn(ClO3)2
Cd(ClO3)2
96,3 7,0 196,2 200,7 326,1
A klorátionok reakcióinak vizsgálatához használjon 0,1 M nátrium-klorát-oldatot.
1. Tömény kénsav. A klorátok elbomlanak, miközben zöldessárga klór-dioxid, ClO2 gáz keletkezik, ami a kénsavban narancssárga színnel oldódik.
A vizsgálatot úgy végezzük, hogy néhány apró kálium-klorát kristályhoz 1 ml tömény kénsavat adunk hidegen. A sárga, robbanásveszélyes klór-dioxid észlelhető, ha a kémcsövet óvatosan összerázzuk. A kémcsövet a gáz robbanásveszélyessége miatt melegíteni nem szabad.
3 KClO3 + 3 H2SO4 2 ClO2 + ClO4
+ 3 SO42
+ 4 H+ + 3 K+ + H2O
2. Tömény sósav. A klorátok elbomlanak, miközben klórgáz és változó mennyiségű explozív klór- dioxid gáz fejlődik. A klór-dioxid sárgára színezi az oldatot. A kísérletet kis anyagmennyiségek- kel végezzük. A keletkező klórgáz a gáztérbe tartott kálium-jodidos keményítős papírt megkékíti és a megnedvesített lakmuszpapírt elszínteleníti.
A következő szimultán reakciók játszódnak le:
2 KClO3 + 4 HCl 2 ClO2 ↑ + Cl2 + 2 K+ + 2 Cl + 2 H2O KClO3 + 6 HCl 3 Cl2 + K+ + Cl + 3 H2O
3. Nátrium-nitrit-oldat. Ha a reagenst és klorátoldatot melegítjük, a klorát redukálódik kloriddá, ami azonosítható az oldat híg salétromsavval való megsavanyítása után ezüst-nitrát-oldattal:
ClO3
+ 3 NO2 Cl + 3 NO3
Kénes savval hasonló reakció játszódik le:
ClO3
+ 3 HSO3– Cl + 3 SO42
+ 3 H+ 4. Cink és nátrium-hidroxid-oldat. A klorát kloriddá redukálódik:
ClO3 + 3 Zn + 6 OH + 3 H2O Cl + 3 [Zn(OH)4]2
A klorid azonosítható, ha az oldatot megsavanyítjuk híg salétromsavval, az el nem reagált cinket szűréssel eltávolítjuk, majd ezüst-nitrátot adunk az oldathoz:
Ag+ + Cl AgCl
5. Kálium-jodid-oldat. Ásványi savakkal erősen megsavanyított oldatban jód keletkezik:
ClO3
+ 6 I + 6 H+ 3 I2 + Cl + 3 H2O
6. Vas(II)-szulfát-oldat. Savas közegben a klorát kloriddá redukálódik, ha az oldatot forraljuk:
ClO3
+ 6 Fe2+ + 6 H+ Cl + 6 Fe3+ + 3 H2O
7.
Ezüst-nitrát-oldat. Csapadék nem észlelhető semleges vagy híg salétromsavas oldatban.8. Bárium-klorid-oldat. Csapadék nem észlelhető.
3.7.6. Ellenőrző kérdések a VIIa-csoport elemeivel kapcsolatban Rendezze, és egészítse ki az alábbi egyenleteket:
1) F2 + 2 H2O 2) Cl2 + H2O
3) Br2 + OH 4) F + H2SO4 5) SiO2 + H2F2 6) AgCl + (NH4)2CO3 7) Cl + MnO2 + H2SO4 8) Cl + Cr2O7
2 + H+ 9) HBrO3 + HI
10) AgBr + Na2S2O3 11) Br + HNO3 12) I2 + Cl2 + H2O 13) Br + Cr2O7
2 + 7 H2SO4 14) I + NO2 + H+ 15) I + 2 NO2 + 4 H+ 16) ClO3 + 3 NO2 17) ClO3
+ 3 Zn + 6 OH + 3 H2O 18) ClO3
+ 6 Fe2+ + 6 H+ 19) ClO3
+ 6 I + 6 H+ Melyik ion nem ad csapadékot ezüst-nitráttal?
F– Br– Cl– I–
Melyik vegyület oldható fel ammónium-karbonátban?
AgCl AgBr AgI
Melyik vegyület oldata lúgos kémahatású?
Na2S Na2SO3 Na2SO4 Na2S2O3
Tömény kénsav hozzáadására melyik vegyületből nem keletkezik színes anyag?
KF KCl KBr KI KClO3
Melyik vegyület oldatából válik le csapadék bárium-kloriddal?
KF KCl KBr KI KClO3
Tömény kénsavas közegben mangán-dioxiddal melyik vegyületből nem keletkezik elemi állapotú halogén?
KF KCl KBr KI KClO3
3.8. Pszeudohalogének és pszeudohalogenidek
Számos egyszerű nitrogéntartalmú vegyület ismert, melyek reakcióikban igen hasonlítanak a halogénekre. Ezeket a vegyületeket pszeudohalogéneknek (álhalogéneknek) nevezzük. A legfontosabb pszeudohalogének a dicián (CN)2, dirodán (SCN)2, diizocianát (OCN)2 és diszelenocianát (SeCN)2. A pszeudohalogének, a halogénekhez hasonlóan dimer molekulákat képeznek, oxidáló tulajdonságuk van és nagyszámú stabil szervetlen és szerves sójuk, illetve kovalens vegyületük ismert. A halogénekhez hasonlóan képesek koordinációs kötést létrehozni, így nagyszámú stabil komplex vegyületük ismert. A halogénekhez hasonlóan előállíthatók egyszerű sóikból elektrolitikus, vagy kémiai oxidációval.
A pszeudohalogenidek (álhalogenidek) a pszeudohalogénekből vezethetők le, hasonlóan ahhoz, ahogy a halogenidek a halogénekből. Az azidokat kémiai reakcióik alapján ugyancsak a pszeudo- halogenidekhez soroljuk, annak ellenére, hogy a megfelelő dimer pszeudohalogén nem létezik.