Klór-acetanilid típusú herbicidek adszorpciójának vizsgálata talajokon és talajalkotókon
Doktori (PhD) értekezés
Írta: Lengyel Zsófia
Témavezető: Dr. Földényi Rita, egyetemi docens
Készült a Veszprémi Egyetem Környezettudományi Doktori Iskolája keretében
Veszprém
2002.
KLÓR-ACETANILID TÍPUSÚ HERBICIDEK ADSZORPCIÓJÁNAK VIZSGÁLATA TALAJOKON ÉS TALAJALKOTÓKON
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Lengyel Zsófia
Készült a Veszprémi Egyetem Környezettudományi Doktori Iskolája keretében Témavezető: Dr. Földényi Rita, egyetemi docens
Elfogadásra javaslom: igen / nem
...
aláírás
A jelölt a doktori szigorlaton ...%-ot ért el.
Veszprém, ...
a Szigorlati Bizottság elnöke Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: ... igen / nem
...
aláírás
Bíráló neve: ... igen / nem
...
aláírás
A jelölt az értekezés nyilvános vitáján ...%-ot ért el.
Veszprém, ...
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése: ...
...
az EDT elnöke
Tartalomjegyzék
KIVONAT ... 5
ABSTRACT... 7
ZUSAMMENFASSUNG ... 8
1. BEVEZETÉS... 9
2. IRODALMI ÁTTEKINTÉS ... 10
2.1. A TALAJ... 10
2.1.1. A talaj ásványi anyagai... 10
2.1.2. A talaj szerves anyagai... 11
2.1.3. A humusz szerepe a talajban... 13
2.1.4. Talajkolloidok... 14
2.2. A NÖVÉNYVÉDŐSZEREKRŐL ÁLTALÁBAN... 14
2.3. KLÓR-ACETANILIDEK A KÖRNYEZETBEN... 16
2.4. ADSZORPCIÓS ELMÉLETEK... 18
2.4.1. Fizikai és kémiai adszorpció... 18
2.4.2. Gázok és gőzök adszorpciója... 19
2.4.2.1. Izotermák alaptípusai... 20
2.4.2.2. Izotermaegyenletek... 21
2.4.2.2.1. A Freundlich-egyenlet ... 21
2.4.2.2.2. Langmuir izotermaegyenlete ... 22
2.4.2.2.3. A BET-elmélet... 23
2.4.3. Adszorpció oldatokból... 24
2.5. NÖVÉNYVÉDŐSZEREK ADSZORPCIÓJA TALAJON... 26
2.6. SZORPCIÓS KÖLCSÖNHATÁSOK... 29
2.7. ANALITIKAI MÓDSZEREK... 33
3. CÉLKITŰZÉSEK... 35
4. KÍSÉRLETI RÉSZ ... 37
4.1. FELHASZNÁLT ANYAGOK... 37
4.1.1. Reagensek, oldószerek... 37
4.1.2. Növényvédőszerek... 37
4.1.3. Adszorbensek... 41
4.1.3.1. A talajok jellemzése... 42
4.1.3.2. Humuszmentes talajok... 44
4.1.3.3. Talajalkotóként vizsgált adszorbensek ... 45
4.2. SZTATIKUS EGYENSÚLYI KÍSÉRLETEK KIVITELEZÉSE... 45
4.2.1. Törzsoldat és hígítási sor készítése... 45
4.2.2. Adszorbensek előkészítése... 45
4.2.3. Növényvédőszeres minták készítése, feldolgozása... 46
4.3. ANALITIKAI MÓDSZEREK... 46
4.3.1. Összes szerves szén meghatározása (TOC)... 46
4.3.2. Nagynyomású folyadékkromatográfia (HPLC)... 47
4.4. BOMLÁSVIZSGÁLAT TALAJON, FELEZÉSI IDŐ MEGHATÁROZÁSA... 47
4.4.1. Extrakció... 47
4.4.1.1. A szilárd fázis extrakciója... 48
4.4.1.2. A folyadék fázis extrakciója ... 48
4.4.2. Tömegspektrometriás elemzés (GC-MS)... 48
4.5. INFRAVÖRÖS SPEKTROSZKÓPIA (IR)... 49
5. EREDMÉNYEK, ÉRTÉKELÉS ... 50
5.1. ADSZORPCIÓS IZOTERMÁK... 50
5.2. INFRAVÖRÖS SPEKTROSZKÓPIÁS VIZSGÁLATOK... 73
5.3. BOMLÁSVIZSGÁLATOK... 74
5.4. A MÉRÉSI EREDMÉNYEK A TOXIKOLÓGIAI ADATOK TÜKRÉBEN... 79
6. ÖSSZEFOGLALÁS... 82
IRODALOMJEGYZÉK ... 85
TÉZISEK... 91
THESES... 94
Kivonat
A népesség növekedése megköveteli a mezőgazdasági termelés egyre hatékonyabbá tételét, így újabb növényvédőszerek kifejlesztését. A mezőgazdaság nagyfokú kemizálása okozta környezetvédelmi problémákkal (pl. vízszennyezés, talajszennyezés) az utóbbi időben kezdtek komolyabban foglalkozni. Nem csak a szerek gyártásakor keletkező anyagok és melléktermékek veszélyeztethetik a környezetet, hanem maguk a szerek is.
A Nitrokémia 2000 Rt. által gyártott acetoklór és propizoklór hazánkban széles körben felhasznált gyomirtószerek, ezért fontos ismerni környezeti viselkedésüket, ezen belül is a jellegzetes magyarországi talajokon (csernozjomon, barna erdőtalajon és homoktalajon) való adszorpciójukat. A sztatikus egyensúlyi kísérletek kivitelezésére három különböző közegben került sor (tiszta víz, 0,1 mol/l NaNO3, 0,1 mol/l pH=7,0 foszfátpuffer), amelynek tanulmányozására az összes szerves szén meghatározása (TOC) az előkísérletek során vizet és 0,1 mol/l NaNO3-ot használva alkalmasnak bizonyult. A 0,1 mol/l pH=7,0 foszfátpuffer közeg esetében a folyadékkromatográfiás (HPLC) elemzés járt rendkívül jól reprodukálható eredménnyel. A három különböző közeg alkalmazása rámutatott arra, hogy a nitrát és foszfát ionok csökkentik az acetoklór mozgékonyságát a vizsgált talajokon (kivéve foszfát homoktalajon). Mivel a HPLC elemzések jóval pontosabb és reprodukálhatóbb eredményeket adtak, mint az összes szerves szén mérése, a vizsgálatok a továbbiakban ezzel a módszerrel történtek.
A talajok humuszmentesített változatain és a talajokban legnagyobb mennyiségben jelenlevő talajalkotókon (kvarc és montmorillonit) is megtörtént az adszorpciós vizsgálat, amelynek során fény derült arra, hogy a talajok ásványos részén levő humuszanyag-fedések az adszorpció szempontjából aktív helyeket takarnak be, azaz a humuszmentes talajokon nagyobb mennyiségű anyag képes adszorbeálódni, mint az eredeti talajokon.
A mérési eredményekből adszorpciós izotermák készültek, amelyekre az eddig ismert (Freundlich és Langmuir) egyenletek nem illeszthetők. A kétlépcsős izotermákra a dolgozatban bemutatott új egyenlet érvényes, amely az adszorpció egyensúlyi
viszonyai mellett figyelembe veszi az adszorptívum molekuláiból keletkező asszociátumok kialakulásának lehetőségét is.
A bomlásvizsgálat eredményeiből látható, hogy mindkét anyag hosszú ideig megmarad a talajban, anélkül, hogy elbomlana.
Az eredmények toxikológiai szempontból való értelmezése figyelmeztet arra, hogy a növényvédőszereket csak mértékkel és felelősséggel szabad felhasználni.
Adsorption of chloroacetanilide type herbicides on soils and soil components
Abstract
Acetochlor and propisochlor are chloroacetanilide type herbicides produced in Hungary. The study of adsorption on different soils and soil components helps predict the fate of these compounds in the environment.
Static equilibrium experiments were carried out with three soils (chernozem, brown forest and sandy soil) and two soil components (quartz and montmorillonite) in three different solutions. Samples in the pure aqueous media and in the 0.1 mol/l NaNO3 solution were analyzed by measurement of TOC. Samples prepared by using the 0.1 mol/l phosphate buffer (pH 7) were analyzed by HPLC.
The obtained two-step adsorption isotherms cannot be evaluated by using the Freundlich or Langmuir equations. New equation has been derived by making use of the usual mass balance and equilibrium relationships of the adsorption and by considering the possibility of the formation of associates of the hydrophobic solute molecules. The calculated curves fit well to the experimentally obtained two-step isotherms and the parameters of the model can be used for the characterization of the pesticide–soil interactions.
Die Adsorption der Unkrautbekämpfer vom Chlorazetanylid Typ im Boden und Bodenkomponenten
Zusammenfassung
Azetochlor und Propisochlor sind Unkrautbekämpfer vom Chlorazetanylid Typ, die in Ungarn hergestellt werden. Die Untesuchung der Adsorption in verschiedenen Böden und Bodenkomponenten hilft bei dem Vorhersagen des Schicksals dieser Komponenten in der Umwelt.
Statische Gleichgewichtsexperimente sind mit drei Böden (schwarze Erde, brauner Waldboden und Sandboden) und zwei Bodenkompenenten (Quarz und Montmorillonit) in drei verschiedenen Lösungen durchgeführt. Die Proben in reinem Wasser und die in 0.1 mol/l NaNO3 Lösung wurden mit TOC gemessen. Die mit 0.1 mol/l Phosphatpufferlösung (pH=7) behandelten Proben wurden mit HPLC analysiert.
Die festgelegten zweistufigen Adsorptionsisothermen sind mit der Hilfe der bekannten Gleichungen (Freundlich, Langmuir) nicht auswertbar. Eine neue Gleichung ist aus der gewöhnlichen Massenbilanz und den Gleichgewichtsverhältnissen der Adsorption aufgestellt worden, die auch die Möglichkeit der Assoziatbildung von gelösten hydrophoben Molekülen berücksichtigt. Die ausgerechneten Kurven passen zu den experimental festgelegten zwiestufigen Isothermen gut an und die Parameters des Modells sind für die Charakterisierung der Insektizid–Boden Wechselwirkungen verwendbar.
1. Bevezetés
A Nitrokémia Rt. által gyártott acetoklór és propizoklór jelentős mennyiségben felhasznált herbicidek. A gyártás során különböző közti- és melléktermékekkel együtt a szennyvízbe kerülhetnek, illetve mezőgazdasági felhasználásuk során a talajt és a felszín alatti vizeket szennyezhetik. Ezért fontos megvizsgálni adszorpciós tulajdonságaikat, amiből következtethetünk arra, milyen mértékben veszélyeztetik a talajt, majd a talajvizet, ami egyik fontos ivóvízforrásunkat képezi. Figyelembe kell vennünk azt is, hogy a hatóanyagok erőteljes adszorpciója az egyes talajokon erózió révén felszíni vizeink szennyezéséhez vezet. Ezek az adatok emberi, s nem utolsósorban környezeti szempontból is fontosak, hiszen a mi érdekünk, hogy vizeink tiszták legyenek és élővilágunk változatosságát megőrizzük.
Dolgozatomban először összefoglalom a legfontosabb ismereteket a talajról és a növényvédőszerekről, áttekintem a legelterjedtebben alkalmazott adszorpciós elméleteket, illetve a talaj és a növényvédőszerek kapcsolatával foglalkozó eddig végzett kutatások eredményeit (2. fejezet).
A Kísérleti részben (4. fejezet) ismertetem a felhasznált szerek ismert tulajdonságait, az adszorbensek jellemzőit, a kísérletek menetét, valamint az alkalmazott analitikai módszereket (összes szerves szén meghatározás, folyadékkromatográfia, tömegspektrometria, infravörös spektroszkópia).
Az 5. fejezetben bemutatom és értékelem a mért adatok alapján készített izotermákat, az illesztett izoterma egyenlet segítségével számított állandókat, valamint a bomlásvizsgálat és az infravörös spektroszkópiás vizsgálatok eredményeit, majd röviden kitérek az élővilágra gyakorolt hatásokra.
Végül összefoglalom a kísérletek eredményeit (6. fejezet).
2. Irodalmi áttekintés
2.1. A talaj
A talaj egy sokkomponensű, háromfázisú, polidiszperz rendszer. Szilárd fázisa ásványi és szerves anyagokból áll, folyadék fázisa a talajoldat, gázfázisa a talajlevegő.
Polidiszperzitására jellemző, hogy a durva homokszemcséktől a kolloid szemcsetartományig a legkülönbözőbb méretű szilárd szemcsék megtalálhatók benne.
2.1.1. A talaj ásványi anyagai
A talaj ásványi részeinek jelentőségét mi sem bizonyítja jobban, mint az a tény, hogy a talaj alkotórészeinek általában több, mint 95%-a ásványi anyag. Ennek összetétele, fizikai és kémiai tulajdonságai igen különbözőek, így a talajok víz- és tápanyag-gazdálkodását, fizikai és kémiai viselkedését nagymértékben befolyásolják.
Talajtani szempontból a következő ásványcsoportoknak van jelentőségük: kloridok, szulfidok, szulfátok, nitrátok, foszfátok, borátok, karbonátok, oxidok, hidroxidok és szilikátok [1]. A szilikátok a talajalkotó ásványok igen változatos csoportját képezik. A SiO4−tetraéderek összekapcsolódásával sziget-, lánc-, szalag-, térrácsos- és rétegszilikátok jöhetnek létre. A rétegszilikátok közül a talajokban az agyagásványok fordulnak elő nagy számban. Egy részük a kőzetekből öröklött, más részük az elsődleges ásványok mállása folyamán keletkezett. Mivel a mállás és a talajképződés elválaszthatatlan, az agyagásványokat úgy kell tekinteni, mint a talajra jellemző ásványokat. Ugyanakkor a talaj agyagos része nem csak az agyagásványokból áll, hanem más kristályos vagy amorf ásványi részekből is.
2.1.2. A talaj szerves anyagai
A talajban található szerves anyagokat tágabb értelemben a következő nagy csoportokba sorolhatjuk:
a talaj élőlényei és a talajon élő növények gyökérzete az elhalt növényi és állati maradványok
a maradványok elbomlása során felszabadult, illetve újraképződött szerves vegyületek
A szerves anyagok utánpótlásának fő forrását a növényi maradványok jelentik.
A szerves maradványok átalakulása bonyolult lebontó és építő mikrobiális folyamatok és az ezekhez kapcsolódó biokémiai reakciók következménye. Lebontásnál a nagy molekulájú vegyületeket a mikroorganizmusok kisebb egységekre bontják, illetve szén- dioxiddá és vízzé alakítják át. A könnyen bontható szerves anyagok – megfelelő feltételek között – gyorsan mineralizálódnak. A nehezen bontható vegyületek jelentős része pedig polimerizálódva és N-tartalmú anyagokkal összekapcsolódva nagy molekulájú, bonyolult szerkezetű vegyületekké, humuszanyagokká alakul. A humuszanyagokat két nagy csoportra oszthatjuk:
1. nem valódi humuszanyagok: ezek közé tartoznak a növényi és állati maradványok bomlástermékei, és a talajban élő mikroszervezetek anyagcseretermékei [2]:
fehérjék, peptidek, aminosavak
szénhidrátok (keményítő, cellulóz, hemicellulóz, pektin, kitin, oldható cukrok)
szerves savak (hangyasav, ecetsav, csersavak stb.) lignin és származékai
zsírok, viaszok, gyanták 2. valódi humuszanyagok
A valódi humuszanyagok bonyolult szerkezetű, savkarakterű polimerek, amelyek egymástól eltérő viselkedésű frakciókból állnak. A különböző humuszfrakciókat klasszikus módon a talaj híg lúgos kezelésével, majd a szűrlet megsavanyításával választhatjuk el egymástól. Ez alapján a híg lúgos kezelés hatására oldatba kerülő anyagokat humuszsavaknak, a nem oldódó részt huminnak nevezzük. A szűrlet megsavanyítása után kiváló csapadék a huminsavakat, az oldat a fulvosavakat tartalmazza. A kivált csapadék alkoholban oldódó részét himatomelánsavaknak nevezzük. A nem oldódó rész kétféle anyagcsoportot tartalmaz: a szürke és a barna huminsavakat.
A humuszanyagok különböző komponensei nem egyforma erővel kötődnek a talaj ásványi részéhez. A szabad humuszanyagok azok, amelyek a CaCO3-hoz, agyagásványokhoz, a Fe- és Al-vegyületekhez nem kapcsolódnak. A gyengén kötött humuszanyagok közé tartozik a Ca2+ által koagulált, valamint az agyagásványokhoz és a Fe2O3-hoz, Al2O3-hoz lazán kapcsolódó humusz. A Fe- és Al-hidroxidokhoz (oxidokhoz) erősen kötött szerves anyagok képezik a nehezen kioldható humuszfrakciót. Végül a humusznak van egy nem mobilizálható része, amely a lúgos és erősen savas kezelés hatására sem oldható ki a talajból.
A humuszanyagok pontos kémiai szerkezete a mai napig sem felderített. Ennek alapvetően az az oka, hogy a humusz igen változatos méretű és különböző szerkezetű molekulákból, összetett anyagcsoportokból áll [1]. Néhány alapvető tulajdonságot azonban sikerült megállapítani:
1. A humuszsavak gyűrűs szerkezetű építőköveket tartalmazó, nagy molekulájú vegyületek.
2. A huminsav molekula vázát egymáshoz kapcsolódott aromás gyűrűk alkotják (legfontosabbak a polifenol és a kinon típusú alkotórészek)
3. A molekulaváz aromás gyűrűi részben közvetlenül, részben pedig hídkötésekkel kapcsolódnak egymáshoz (pl. −O–; –NH–; =N–; –C≡C–; –S–) 4. A vázhoz jellemző oldalláncok kötődnek, melyek főként szénhidrátszerűek,
peptid vagy aminosav jellegűek.
5. A huminsavak tulajdonságait jelentősen befolyásoló reaktív csoportok mind a vázon, mind az oldalláncokon előfordulnak. Ezek közül a karboxil, fenolos-OH, az alkoholos-OH és a karbonil csoportok savas jellegűek, az imino és az amino csoportok bázikusak.
6. A nitrogén a humuszban három fő kötési formában fordul elő: mag-N (heterociklusos gyűrűkben), híd-N és reaktív csoportokban levő N.
2.1.3. A humusz szerepe a talajban
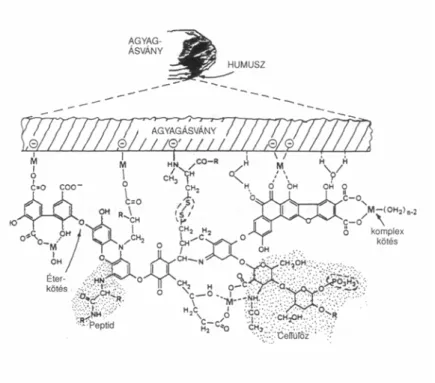
A humuszanyagok döntő szerepet játszanak a talajok szerkezetének kialakításában. Mivel a huminsavak kétvegyértékű fémionokkal alkotott sói vízben nem oldódnak, a Ca-humátok által összeragasztott aggregátumok vízállóak és porózusak. A huminsavak Fe- és Al-oxidokkal/hidroxidokkal társulva – agyagásványok jelenlétében – szintén tartós szerkezeti elemek kialakulásához vezetnek. Igen jelentős szerkezetkialakító tényező a szerves és az ásványi kolloidok összekapcsolódásával létrejött agyag–humusz komplexum, amelynek sémáját az 1. ábra mutatja [1].
1. ábra: A szerves–ásványi komplexum felépítésének sémája
2.1.4. Talajkolloidok
A kolloidokra jellemző 1-500 nm-es mérettartománnyal szemben a talajokban 2 µm-es szemcseátmérőt fogadtak el felső határnak, amelyet az agyagásványok lemezes szerkezete és több talajkolloid nagy belső felülete tesz indokolttá. Alakjuk szerint megkülönböztetünk lamelláris (pl. montmorillonit, kaolinit stb.), fibrilláris (pl.
humuszkolloidok) és korpuszkuláris (pl. finomeloszlású kvarc-, csillám- vagy földpátszemcsék stb.) kolloidokat. Ha a részecskék felületén ionok, ionizált csoportok vagy poláris molekulák vannak, akkor a kolloid felülete poláris. Attól függően, hogy a felületi töltések zömmel negatívak vagy pozitívak-e, a poláris felületek elektronegatív vagy elektropozitív jellegűek lehetnek. A talajkolloidok túlnyomó része elektronegatív.
2.2. A növényvédőszerekről általában
A mezőgazdasági termelés növekedésével egyre inkább kívánatossá vált olyan anyagok kifejlesztése, amelyek segítségével a termés mennyisége növelhető, illetve megakadályozható a kártevők elszaporodása. A különféle növényvédőszerek (peszticidek) ezeket a célokat szolgálják. A leggyakoribb növényvédőszer fajták a következők: herbicidek (gyomirtók), fungicidek (gombaölők), és inszekticidek (rovarölők).
A gyomirtószerek közé igen sokféle hatásmódú anyag tartozik. Ez alapján megkülönböztetünk fotoszintézis gátlókat, fehérjeszintézis gátlókat, csírázás gátlókat, növekedési zavarokat okozókat, légzési folyamatokat gátlókat, valamint egyéb módon ható szereket.
Alkalmazása során minden növényvédőszer kapcsolatba kerül a talajjal. A talajra kiszórt peszticidek rögtön a kijuttatáskor, a többi szer az időjárástól függően rövidebb vagy hosszabb idő múlva. A talajban a növényvédőszerek különféle folyamatokon mennek keresztül, amelyek sem helyileg, sem időben nem különíthetők el egymástól, ezért egymásra is kölcsönösen hatnak [3].
Ezek a folyamatok a következők:
abszorpció és felszívódás a növényekbe és az állatokba fennmaradás a vegetációban, majd a termésben
adszorbeálódás a talajon
párolgás (mozgás a levegőn keresztül az atmoszférába) erózió (felületi lemosódás, oldódás)
kapilláris áramlás (mozgás a talajon keresztül) lebomlás (biológiai, kémiai, fotokémiai)
A peszticidek kijuttatás utáni sorsát mutatja az 2. ábra [4]:
P=PESZTICID
TERMÉS BETAKARÍTÁS DETOXIKÁLÁS
P
P P P
P P P P
LEMOSÓDÁS PÁROLGÁS
P ABSZORPCIÓ FOTOLEBOMLÁS
P
BIOLÓGIAI LEBOMLÁS
KAPILLÁRIS ÁRAMLÁS P P
KIMOSÓDÁS
TALAJVÍZ P
KÉMIAI LEBOMLÁS
ADSZORPCIÓ P
P
2. ábra: Peszticidek sorsa a talajban kijuttatásuk után
2.3. Klór-acetanilidek a környezetben
A környezetvédelem jelentősége a közelmúltban egyre nagyobb lett, így a kutatókat nem csak az foglalkoztatta, hogy egy szer minél hatékonyabb legyen, hanem az is, hogy az adott szer minél kevésbé károsítsa a környezetet. Ezért olyan irányú kutatások is megindultak, amelyek célja a növényvédőszerek környezeti sorsának tanulmányozása volt. Ilyen módon a talajhoz való kötődés, a bomlás mechanizmusa és a bomlástermékek, a talajban való mozgás vizsgálata az érdeklődés középpontjába került.
Környezetvédelmi szempontból az sem elhanyagolható, hogy a szerek maradékaira, bomlástermékeire milyen környezeti sors vár, például bekerülnek-e az élővizekbe, az élő szervezetbe, s ott milyen hatást váltanak ki.
Az acetoklór a világ sok helyén alkalmazott klór-acetanilid típusú herbicid, amelyet legnagyobb mennyiségben kukoricaföldeken használnak. Az Egyesült Államok területén széles körben használják a farmergazdaságokban, vagyis szinte az ország egész területén. 1994 márciusában az USA Környezetvédelmi Ügynöksége (EPA) az acetoklórt feltételesen olyan herbicidnek nyilvánította, amely részben alkalmas más kukorica-herbicidek helyettesítésére [5]. A kutatások sokszor arra irányultak, hogy az esetleges szermaradékokat, bomlástermékeket kimutassák a felszíni vizekben illetve a talajvízben, ugyanis az EPA-dokumentum szerint az acetoklór és bomlástermékei mérsékelten perzisztensek, mindemellett nagyon mozgékonyak is lehetnek a talajban, attól függően, hogy a talaj, ahol alkalmazzák, milyen tulajdonságokkal rendelkezik. Ez arra utal, hogy az acetoklór maradványok relatíve nagy eséllyel kerülhetnek be a felszíni és talajvizekbe. Minnesota államban a Blue Earth folyó mentén végzett mérésekből [6]
kiderül, hogy az 1994 tavaszától nyár végéig tartó mintavételezés során minden egyes folyóvíz- és esővíz-mintában kimutatták az acetoklórt 10−250 ng/l koncentrációban.
Mivel az Egyesült Államokban 1994-ben vették először nyilvántartásba az acetoklórt mint kukoricán használatos vegyületet, ismeretlen volt, mekkora mennyiséget használtak belőle abban az évben a Blue Earth folyó vízgyűjtőterületén. Becslések szerint a farmereknek kb. 10%-a alkalmazott acetoklórt 1994 tavaszán. A szer ilyen mértékű jelenléte az esővízben és a folyóvízben azt jelezte, hogy folyamatos
megfigyelésre és az acetoklór környezeti viselkedésének tanulmányozására van szükség.
Kolpin és munkatársai az acetoklór, és két másik klór-acetanilid típusú vegyület, az alaklór és a metolaklór jelenlétét vizsgálták talajvízben, felszíni vizekben és esővízben az Egyesült Államok középnyugati részén [7]. Az acetoklór már alkalmazásának első évében helyettesítette bizonyos mértékben az egyéb kukorica−herbicideket: ezeken a területeken 1994-ben hozzávetőleg 3,4 millió kg acetoklórt használtak. A felszíni vizekben és az esővízben minden mintavételi helyen kimutatható volt az acetoklór, a talajvízben azonban nem. Ennek okát többféleképpen magyarázzák: pl. az anyag talajban való gyors lebomlásával, vagy azzal, hogy az acetoklór a kiszórás és a mintavétel között eltelt idő alatt nem érhette el a mintavételi helyeket. Ugyanakkor a másik két herbicidből minden mintában jóval nagyobb mennyiséget mutattak ki, aminek az az oka, hogy ezekből nagyobb mennyiséget is alkalmaztak, mint az acetoklórból. (1994-ben az acetoklór még csak részben helyettesítette a többi kukoricában alkalmazott herbicidet.)
Nem csak magukat a vegyületeket kutatták a felszíni és talajvizekben, hanem a bomlástermékeiket is. Kalkhoff és munkatársainak kutatásából kiderül, hogy az acetoklór, alaklór és metolaklór bomlástermékei nagyobb mennyiségben találhatók meg Iowa állam vizeiben, mint az eredeti anyagok [8]. Mindhárom vegyületet, valamint oxálsav-anilid és szulfonsav metabolitjukat tudták azonosítani felszíni és talajvizekben.
Ez utóbbiakról feltételezik, hogy növényekben, algákban és talajbaktériumokban glutation konjugációs folyamatokat eredményeznek. A talajvíz-minták esetében megállapították, hogy a vegyületek mennyisége a következőképpen változik: szulfonsav származék >> oxálsav-anilid származék >> eredeti vegyület. Ennek megfelelően a vegyületek mozgékonysága is hasonló tendenciát mutat. Az eredmények arra utalnak, hogy a metabolitok jóval stabilabbak, mint az eredetileg kijuttatott anyagok. A különböző klór-acetanilid származékok kimutatott mennyisége a következő sorrendben csökken: metolaklór alkotók > alaklór alkotók > acetoklór alkotók. Ez részben az alkalmazott mennyiségek közti különbségnek, részben az eltérő fizikai tulajdonságoknak és bomlási mechanizmusnak köszönhető. A felszíni vizekből vett
minták esetében megállapították, hogy az oxálsav-anilid és szulfonsav metabolitok jóval nagyobb koncentrációban találhatók meg, mint az eredeti vegyületek. Minden mintavételi helyen legalább az egyik metabolit jelen volt. A talajvíz-mintákhoz hasonlóan a vegyületek detektált mennyisége a szulfonsav metabolit > oxálsav-anilid metabolit > eredeti vegyület csökkenő sorrendet követi. Az eredeti vegyületek átlagos koncentrációja 0,13 µg/l, míg a metabolitoké 6,4 µg/l volt. Az eredményekből arra következtettek, hogy a három legfontosabb klóracetanilid-típusú herbicid általánosan jelen van mind a felszíni vizekben, mind pedig a talajvízben. A szerzők fontosnak tartják az eredeti vegyületek és a metabolitok mennyiségi meghatározását, mivel így jobban megérthető ezen anyagok környezeti viselkedése és transzportja a hidrológiai rendszerben. Még nem tisztázott ugyanis, hogy ezek a szerek milyen hatással vannak az ökoszisztémára és az emberi egészségre.
2.4. Adszorpciós elméletek
Az előbbiekben említett környezeti viselkedés, illetve a környezetben való transzport szoros összefüggésben van a növényvédőszerek adszorpciós tulajdonságaival, elsősorban a molekulák és a talaj közötti kölcsönhatással. Ezen folyamatok megértéséhez elengedhetetlenek az adszorpciós elméletek, amelyek alapot adnak a talaj és a növényvédőszerek közötti bonyolult kölcsönhatások megismeréséhez.
Az adszorpcióról szóló elméleteket a különböző izotermák alapján először gázokra alkották meg, de mint azt a 2.4.3 fejezetben bemutatom, oldatok esetében is alkalmazhatóak, hiszen az adszorbens által megkötött adszorptívum mennyisége mindkét esetben a folyamatokban résztvevő anyagok természetétől és koncentrációjától függ [9].
2.4.1. Fizikai és kémiai adszorpció
A molekulák két módon kötődhetnek a felülethez: fiziszorpcióval vagy kemiszorpcióval [10].
A fiziszorpció esetén van der Waals-típusú kölcsönhatások (például diszperziós és dipólus kölcsönhatások) vannak az adszorbens és a szubsztrátum (adszorptívum) között. A van der Waals-kölcsönhatások – bár elég nagy a hatótávolságuk − gyengék, az adszorpció során felszabaduló energia hasonló nagyságrendű, mint a kondenzáció esetén. Ilyen kis mennyiségű energia a rács rezgésein adszorbeálódik és hőmozgás formájában disszipiálódik, azaz már vissza nem alakítható hőenergiává alakul. A molekula a durva felületen "pattog", fokozatosan elveszti energiáját és végül adszorbeálódik, mintegy elhelyezkedik. A fizikai adszorpció entalpiája –20 kJ/mol körül van. Ez az entalpia nem elegendő arra, hogy kémiai kötéseket felszakítson, így a fizikailag kötött molekula megőrzi tulajdonságát, bár szerkezete a felületen bizonyos mértékig eltorzulhat.
A kemiszorpció során a felülethez ütődő részecske kémiai (rendszerint kovalens) kötést képez és úgy mozog a felületen, hogy maximális koordinációs számot alakítson ki az adszorbenssel. A kemiszorpció entalpiája sokkal nagyobb, mint a fiziszorpcióé, tipikus nagysága –200 kJ/mol. A kemiszorbeált molekula teljesen szétszakadhat a felületi atomok lekötetlen vegyértékeinek megfelelően.
Nem csak a gáztérben levő szabad molekulák adszorbeálódnak, hanem a felületre adszorbeálódott molekulák is deszorbeálódnak, tehát dinamikus egyensúly van közöttük, egymással állandóan kicserélődhetnek. A molekulák meghatározott átlagos tartózkodási idővel kötődnek a felülethez. Kemiszorpció esetén ez a tartózkodási idő igen hosszú, sőt gyakorlatilag végtelen nagy is lehet, ha felületi komplex képződik [11].
2.4.2. Gázok és gőzök adszorpciója
Az adszorpció mértéke függ mind az adszorbens, mind az adszorptívum tulajdonságaitól. E tekintetben lényeges az adszorbens fajlagos felületének nagysága, a kapilláris kondenzáció, az adszorbens porozitása, a felületi energia nagysága és az adszorptívum minősége [12]. Az adszorbens és az adszorptívum közötti kölcsönhatás erősségét a hőmérsékleten túl a két komponens kémiai minősége is befolyásolja. Ezek alapján az adszorpciós izotermák lefutása igen különböző lehet. Az adszorpciós
izotermák a fajlagos adszorbeált mennyiség vagy felületi koncentráció és az egyensúlyi gáz- vagy gőznyomás közötti kapcsolatot adják meg adott hőmérsékleten.
2.4.2.1. Izotermák alaptípusai
A különböző adszorbens–adszorptívum-párokra kísérletileg kapott adszorpciós izotermák igen változatos alakúak. A görbék alakja elsősorban attól függ, hogy az adszorptívum kritikus hőmérséklete felett vagy alatt történt a meghatározás. A kritikus hőmérséklet felett (gázok esetében) az izotermák alakja mindig Langmuir-típusú; kis nyomáson közel lineáris, majd az abszcisszával párhuzamos szakaszba hajlik át, amely az adszorpciós telítettségnek felel meg. A kritikus hőmérséklet alatt (gőzöknél) az adszorpciós izotermák jellege erősen eltérhet a Langmuir-félétől.
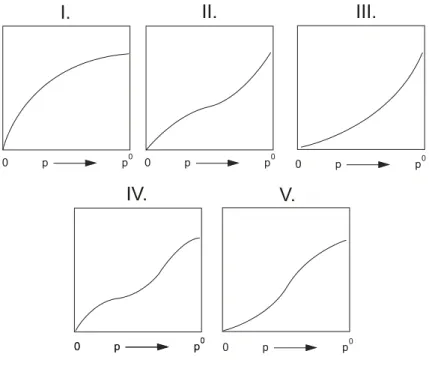
A fenti esetekre Brunauer és munkatársai az adszorpciós izotermák öt alaptípusát különböztetik meg, amelyek a 3. ábrán láthatóak [11].
3. ábra: A adszorpciós izotermák öt alaptípusa Brunauer és munkatársai szerint
Az I., IV. és az V. típus az abszcissza, a II. és a III. típus az ordináta felé hajlik a kísérletileg elérhető telített gőznyomásnál (p0). Igen gyakori az I. típus (Langmuir), amely a kritikus hőmérséklet feletti gázok fizikai adszorpciójára jellemző.
Kemiszorpció esetén kizárólag az I. típusú izotermák fordulnak elő, amelyek már viszonylag kis gáznyomáson megközelítik a felület telítettségének megfelelő értéket.
Az izotermák között gyakori még a II. és a IV. típus, az előbbi sima felületű és pórusos adszorbenseken egyaránt, az utóbbi kizárólag pórusos adszorbenseken figyelhető meg gőzök adszorpciójakor. A ritkább III. és V. típust az jellemzi, hogy az izoterma növekvő meredekséggel indul.
2.4.2.2. Izotermaegyenletek
A kísérletek során kapott izotermák sokszor csak jó közelítéssel írhatók le valamilyen függvénnyel. Ezek az egyenletek legtöbbször a görbének csupán bizonyos szakaszára érvényesek.
2.4.2.2.1. A Freundlich-egyenlet
A 3. ábrán bemutatott I. típusú görbe középső szakasza egy tört kitevőjű hatványfüggvénnyel írható le [11]:
p n
k
mσ = ⋅ 1 n > 1 (1)
ahol mσ az adszorbeált mennyiség, p az egyensúlyi nyomás, míg k és 1/n az adott adszorbens–adszorptívum párra jellemző állandók, amelyek függnek az izoterma hőmérsékletétől. Az (1) egyenletet Freundlich-izoterma néven említik, amelynek logaritmikus alakja:
n p k
m 1 lg
lg
lg σ = + ⋅ (2)
Eszerint az izotermának kétszeresen logaritmikus ábrázolásban egyenest kell adnia, amelynek iránytangense 1/n, tengelymetszete lg k értékét adja. Az egyenlet az I. típusú izotermáknál is csak közepes borítottságnál ad kielégítő leírást, azaz az izotermák középső, nem túl hirtelen áthajló szakaszára érvényes.
Az izotermák kezdeti, lineáris szakaszára a (3) összefüggés érvényes, amelyet Henry-féle tartománynak szokás nevezni:
p konst
mσ = ⋅ (3)
2.4.2.2.2. Langmuir izotermaegyenlete
Langmuir az izoterma-egyenlet levezetéséhez kinetikai meggondolást alkalmazott, amelyhez a következő feltételeket rendelte: az adszorbens felületéhez ütköző molekula tapadva marad, ha ún. adszorpciós helyhez ütközik. Ha azonban ez a hely foglalt, akkor a molekula visszapattan a felületről. Ebből a feltételezésből az is következik, hogy nem jöhet létre polimolekulás réteg. A feltételezés szerint az adszorbeált szomszédos molekulák között nincs kölcsönhatás. Ezek alapján a Langmuir-izoterma az alábbi (4) összefüggéssel írható fel [12]:
b p m p
mσ = σ0 ⋅ + (4)
amelynek linearizált alakja:
σ σ σ
0
0 m
p m
b m
p = + (5)
ahol p az egyensúlyi nyomás, b az adszorpció egyensúlyára jellemző állandó, mσ az adszorbeált mennyiség, és moσ a maximálisan adszorbeált mennyiség. Ez utóbbi a
monomolekulás telítettségnek felel meg, mert mindaddig adszorpciónak kell bekövetkeznie, amíg a felületen szabad adszorpciós hely van.
2.4.2.2.3. A BET-elmélet
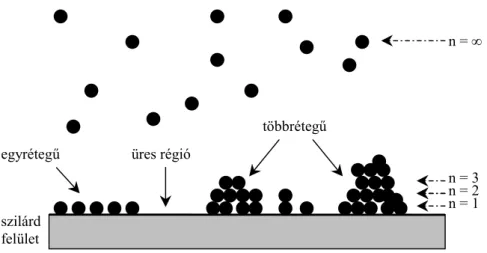
Brunauer I., P. H. Emmett és Teller E. a Langmuir-féle modellt azzal egészítették ki, hogy a monomolekulás réteg kialakulása után az adszorpció nem szűnik meg, hanem az első rétegre továbbiak képesek lerakódni [11]. Az egyes rétegek kialakulását a 4. ábra mutatja [13]:
egyrétegű üres régió
többrétegű
n = 1 n = 2 n = 3 n = ∞
szilárd felület
4. ábra: Egy- és többrétegű adszorpció szilárd felületen
Feltételezték azonban, hogy a tulajdonképpeni adszorpciós kötés csupán a felület és az első molekularéteg között alakul ki, míg a további rétegek lényegében az elsőre kondenzálódnak, ezek kötési energiái tehát a kondenzátum párolgáshőjének felelnek meg. Az adszorpciós–deszorpciós egyensúly csak a legfelső molekularétegre áll fenn. E feltevések alapján a BET-egyenlet (ill. annak linearizált alakja) a (6) egyenlettel írható fel:
(
0)
0 0 01 1
p p C m
C C m p p m
p ⋅
⋅ + −
= ⋅
−
⋅ σ σ
σ (6)
ahol p0 a telített gőznyomás, C empirikus állandó, a többi paraméter jelentése pedig megegyezik az (5) egyenlet paramétereivel.
2.4.3. Adszorpció oldatokból
Oldatokból általános esetben bármelyik komponens felhalmozódhat a szilárd anyag és az oldat határfelületén. Az adszorpciós viszonyok emiatt igen bonyolultak, hiszen még a legegyszerűbb esetben is, amikor az oldószer mellett csak egyetlen oldott anyag van jelen, elvileg mindkét komponens adszorpciójával kell számolni. Az adszorpciós folyamat valójában a szilárd felület és az oldószermolekulák közötti versengés az oldott anyag molekuláiért, illetve az oldószer és az oldott molekulák közötti versengés a szilárd felületért (kompetitív adszorpció). A legegyszerűbb esetben, amikor híg oldatról van szó és az oldott anyag nagyon jól adszorbeálódik az oldószerhez képest (az oldószer adszorpciója elhanyagolható), a kísérletileg meghatározott izotermák a gázadszorpciónál bemutatott Freundlich- (1) vagy Langmuir-féle egyenlettel (4) írhatók le annyi módosítással, hogy az adott összefüggésben az egyensúlyi nyomás helyett az adszorptívum egyensúlyi koncentráció értéke szerepel (c).
A gyakorlatban az oldott anyag mellett legtöbbször számolni kell az oldószer, illetve – kétkomponensű elegy esetén, széles koncentrációtartományban – mindkét komponens megkötődésének lehetőségével [11]. Ekkor mindkét komponens részt vesz a felületi réteg felépítésében valamilyen arányban. Ha valamelyik komponens feldúsul a határrétegben az oldat belsejéhez képest, létrejön az ún. Gibbs-féle felületi többlet, tehát a kérdéses komponensből a felületi rétegben nagyobb anyagmennyiség lesz, mint az oldat- vagy elegyfázis ugyanakkora térrészében. Ekkor beszélünk a kérdéses komponens pozitív adszorpciójáról. Ez az anyagmennyiség „eltűnik” az oldatból, tehát az oldat adszorpció utáni egyensúlyi koncentrációja kisebb lesz, mint a kiindulási koncentráció volt. Az „eltűnt” anyagmennyiséget, amelyet a koncentráció-csökkenésből ki tudunk számítani, vagy felületegységre, vagy az adszorbens egységnyi tömegére vonatkoztatjuk. Az előbbi a felületi többletkoncentráció, az utóbbi a fajlagos felületi többlet (amely híg oldatokból történő adszorpció esetén gyakran adszorbeált
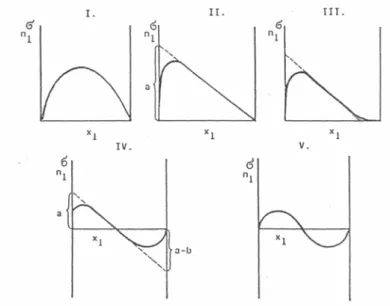
mennyiségként szerepel a szakirodalomban, pl. [14], [15]). Az adszorpciós izotermának megfelelő jellemző függvény a felületi többletizoterma, amely valamelyik komponens adszorpciós felületi többlete és egyensúlyi koncentrációja közötti összefüggést írja le, állandó hőmérsékleten és nyomáson. A Schay–Nagy-féle rendszerezés szerint öt alaptípusba sorolhatók a többletizotermák, amelyek az 5. ábrán láthatók [16].
5. ábra: A Schay–Nagy szerinti többletizoterma-típusok
A II., III. és IV. típusú görbék közös jellemzője, hogy a többletizoterma egy viszonylag hosszú szakasza lineáris, amelynek mentén a felületi réteg összetétele közel állandó.
Giles és munkatársai szerves anyagok oldatának szilárd felületen való adszorpcióját az izotermák kezdeti görbülete alapján négy fő osztályba, ezeken belül pedig öt (összesen húsz) alcsoportba sorolták [17]. Ez az osztályozás többek között magába foglalja a Brunaer és munkatársai által eredetileg gázok és gőzök adszorpciójára megkülönböztetett öt típust (lsd. 2.4.2.1. fejezet), továbbá néhány, a tömény kétkomponensű folyadékelegyek esetében tapasztalt görbét is. A négy fő osztály a következő: S, L („Langmuir”-típus), H („high affinity”) és C („constant partition”) izotermák.
Az S-görbe esetén a koncentráció növekedésével az adszorpció mértéke nő.
Abban az esetben tapasztalható ez a fajta izoterma, ha az adszorptívum molekulájára
teljesül a következő három feltétel: a molekula egyértékű, közepes mértékű intermolekuláris vonzást gyakorol a többi molekulára, amelyek így szabályosan rendeződnek az adszorbeált felületen (általában függőlegesen), és erősen verseng az adszorbens aktív helyeiért az oldószer molekuláival vagy más adszorbeált molekulákkal.
Az L-izotermák esetén a kezdeti görbület azt mutatja, hogy minél több hely van betöltve a felületen, annál nehezebb a hozzá ütköző molekulának szabad helyet találnia.
Ez azt vonja maga után, hogy az adszorbeált molekula vagy nem függőlegesen orientálódik, vagy pedig nem verseng az oldószer molekuláival.
A H-görbék az L-görbék olyan speciális esetei, amikor az oldott anyag molekulái teljes mértékben adszorbeálódnak, vagy legalábbis az oldatban nem marad mérhető mennyiség belőlük. Az izoterma kezdő szakasza ezért függőleges. Az adszorbeálódó részecskék gyakran nagy méretűek (pl. ionos micellák vagy polimer molekulák), de néha egyszerű ionok, amelyek olyan molekulákkal cserélődnek ki, amelyek kisebb erővel kötődnek a felülethez.
A C-görbét az adszorptívumnak az oldószer és a felület közötti állandó megoszlása jellemzi, egészen a lehetséges maximális adszorbeált mennyiségig, ahol hirtelen egy vízszintes plató alakul ki. A linearitás alapvetően azt jelenti, hogy minél több molekula adszorbeálódik, annál több adszorpciós hely keletkezik.
2.5. Növényvédőszerek adszorpciója talajon
A talajnak mind az agyagásványos, mind a szerves frakciója fontos szerepet kap az adszorpciós folyamatokban. A napjainkban használatos növényvédőszerek elsősorban szerves vegyületek, amelyek vízoldhatósága korlátozott. Talajon történő megkötődésüket ezért a híg oldatokból való adszorpció alapján kell tárgyalnunk. Ez figyelhető meg Green munkásságában is, aki néhány vegyület agyagásványokon való adszorpcióját vizsgálta [18], és az izotermákat a Giles által leírt [17] négy alapgörbe egyikével jellemezte. A paraquat (amely egy pozitív töltésű herbicid) adszorpciója esetében H-görbét kapott. Egy triazin típusú herbicid, a prometon vizsgálata L-görbét
eredményezett. C-típusú görbe jellemezte a lindán és a hexakloro-ciklohexán adszorpcióját. A Dasanit nevű tiofoszfát inszekticid adszorpciója S-típusú görbével írható le.
A peszticidek biológiai hozzáférhetőségét és környezeti transzportját a talaj–víz rendszerben az anyagok adszorpciós tulajdonságai határozzák meg. Az adszorpció mértéke az egyik legfontosabb paraméter a különféle anyagok hidrogeokémiai transzport modelljeiben [14], [19], [20]. A vizsgált anyag egyensúlyi megoszlását a talaj és a víz között az izoterma egyenletek általános alakjával jellemzik, amelyben az adszorbeált anyag mennyisége az egyensúlyi koncentráció függvénye:
) (c f
q= (7)
ahol q az adszorbeált anyag mennyisége az adszorbens 1 g-ján és c az anyag egyensúlyi koncentrációja az oldat fázisban. A kölcsönhatásoktól függően a (7) egyenlet különböző formájú lehet.
A hidrofób szerves anyagoknak a talajokon bekövetkező megkötődése az ún.
DR-modell-lel (Distributed Reactivity Model) írható le [21], amely szerint az adszorbens különböző aktivitású helyekkel rendelkezik. A talaj alapvetően sokkomponensű, háromfázisú rendszer, amely szervetlen és szerves anyagokból áll, s ezeken az adszorpció egyedi izotermákkal jellemezhető. A szerves szennyezők adszorpciója a szervetlen ásványi összetevők felületén nemlineáris Langmuir- izotermákkal írható le. A talaj szerves összetevőinek egyik része a geológiailag idősebb szerves frakció (kerogén, szenek stb.), amely viszonylag hidrofób felületet biztosít.
Ezen a szennyezők retenciója a Freundlich-izotermával írható le. A talaj szerves anyagainak másik típusa geológiailag fiatalabb anyag (humuszanyagok stb.), ami jó megoszlást biztosít a hidrofób molekulák számára, így az anyag retenciója lineáris izoterma egyenlettel jellemezhető. A DR-modell egyesíti ezeket a lineáris és nemlineáris adszorpciós izotermákat, tehát a teljes adszorbeált mennyiség bármilyen oldat koncentrációnál közelítőleg az egyedi izotermák összegeként adható meg (8):
∑
=⋅
= m
i
i i
r x q
q
1
(8)
ahol qr az oldott anyag teljes koncentrációja a szilárd fázisban, qi az i-edik egyedi izotermának megfelelő adszorbeált koncentráció, xi pedig az adott szilárd fázis összetevő tömegtörtje.
Amint azt a (8) egyenlet mutatja, a DR-modell az összeadódó mennyiségeket a különféle talajösszetevők tömegtörtjei alapján súlyozza. A talajösszetevők felelősek a részfolyamatokért, a különböző aktivitású helyeken történő adszorpcióért.
Mivel a talajalkotó részek tömegtörtje 0-tól 1-ig változhat, az adszorpcióban valóban domináns lehet egy adott mechanizmus, amint az gyakran látható olyan talajok esetében, ahol a Freundlich- és Langmuir-izoterma egyenletek nyilvánvalóan megfelelőek a kísérleti adatok leírására. Különböző izotermákat írtak le a hidrofób szerves szennyezők talajon való adszorpciójára, amelyeket Samiullah összegzett [22]. A leggyakrabban említett összefüggés a Freundlich-egyenlet [23] [24], de a Langmuir- [25] [26] és a több tagú Langmuir-izotermák (9), [22] [27] is megfelelőnek bizonyultak a szennyező anyag − talaj kölcsönhatások jellemzésére.
Ez utóbbi több, egymástól független homogén aktív centrum szorpciós folyamatban bekövetkező részvételére vonatkozik:
∑
= + ⋅⋅
= m ⋅
i i
Ti i
c K
c q q K
1 1 (9)
ahol qTi az i-edik típusú kötőhely által adszorbeált maximális mennyiség, míg Ki az adszorpciós koefficiens, q az adszorbeált anyag mennyisége az adszorbens 1 g-ján, c az anyag egyensúlyi koncentrációja az oldat fázisban.
A adszorbens és az oldott anyag számos különböző tulajdonsága fogja végül is meghatározni, melyik retenciós folyamat dominál. A talaj esetében ezek a tulajdonságok a pórusszerkezet, az anyag által hozzáférhető felület, a felület polaritása, a szerves szén tartalom, a talaj szerves anyagának kétféle frakciója stb. Míg a rendszer ezen jellemzőit általában figyelembe veszik az adszorpciós modellek, addig jóval kevesebb figyelmet szentelnek a szennyező anyag fizikai-kémiai tulajdonságainak (méret, polaritás, polarizálhatóság, funkciós csoportok stb.). A molekula tulajdonságaival kapcsolatban álló kölcsönhatások magyarázatot adhatnak az izoterma
jellegzetes jegyeire, pl. az S-formájú izotermára. A monomer és dimer oldott molekulák ún. egyesített adszorpciója S-formájú görbét eredményez, amely a következő kétparaméteres Langmuir-egyenlettel (10) írható le [15]:
⋅
⋅ +
⋅ +
⋅
⋅ +
⋅ ⋅
= 2
2 1
2 2 1
2 1
2
c K c K
c K c N K
q (10)
ahol c az oldott anyag monomerjének egyensúlyi koncentrációja, N az adszorpciós helyek száma, K1 és K2 rendre a monomer és dimer molekulák adszorpciós egyensúlyi állandói.
2.6. Szorpciós kölcsönhatások
A peszticidek környezeti sorsában a szorpció két formája játszik szerepet: az adszorpció és az abszorpció. Ezeket az alapján különböztetjük meg, hogy a molekulák milyen mértékben lépnek kölcsönhatásba a szorbens fázissal. Adszorpció esetén az oldott anyag az oldat és az adszorbens határfelületén halmozódik fel. Ezzel ellentétben az abszorpció olyan folyamat, amelyben az oldott anyag molekulái néhány nanométer mélységben behatolnak a szorbens fázisba (pl. két, relatíve nem elegyedő fázis keveredésekor, vagy egy lipofil anyag szerves felületen való felhalmozódásakor)[14].
Almendros vizsgálataiban arra keresett választ, hogy talajból kinyert huminsavak, amelyeknek néhány, szorpciós szempontból feltehetőleg lényeges szerepet játszó szerkezeti tulajdonságát megváltoztatta, milyen kölcsönhatásba lépnek 12 eltérő kémiai tulajdonságú növényvédőszerrel [28]. Kísérletei során a huminsavak tulajdonságai és a peszticid-szorpció, valamint a növényvédőszerek tulajdonságai és a szorpciós kölcsönhatások közötti összefüggéseket vizsgálta. Megállapította, hogy szorpciós szempontból a huminsavak rendkívül aktív talajkomponensek, továbbá hogy a talaj szerves anyaga számos esetben nagyobb hatással van az adszorpcióra, mint az ásványi összetevők. A szorpciós kölcsönhatások nagymértékben változhatnak attól függően, hogy milyen a huminsav összetétele. Mindazonáltal úgy tűnik, hogy egy adott
peszticid kedvezményezett kötődését a különféle huminsav-frakciókhoz mindkét molekula fizikai-kémiai tulajdonságai, szerkezete, és funkciós csoportjai befolyásolják.
A növényvédőszerek és a talaj humuszanyagai között kialakuló kölcsönhatások mechanizmusait vizsgálta Senesi [29]. Ez az adszorpciós folyamatok feltárásának szempontjából igen fontos. A növényvédőszerek talajban való viselkedése több különböző és gyakran egyidejűleg jelen levő folyamatot foglal magába, így kémiai, biológiai és fotokémiai bomlást, transzportot és felhalmozódást, párolgást és kimosódást. Ezeket a folyamatokat nagymértékben befolyásolják különféle fizikai, fizikai-kémiai, biokémiai, kőzettani és klimatikus tényezők. A talaj adszorpciós szempontból legaktívabb része a humuszanyag, amely polidiszperz, polielektrolit karakterű, reakcióképes funkciós csoportokat tartalmaz és felületaktív tulajdonságokkal rendelkezik, valamint a molekulán hidrofil és hidrofób helyek egyaránt jelen vannak.
Mindezek a tulajdonságok lehetővé teszik a szerves növényvédőszerekkel való kölcsönhatást, amely igen sokféle lehet.
Ionkötéses vagy kationcserés adszorpció csak olyan peszticidmolekulákkal jöhet létre, amelyek kationos formában vannak vagy protonfelvételre képesek. Ez azt jelenti, hogy a humuszanyag disszociált vagy disszociábilis, illetve karboxil- és fenolos OH- csoportokat tartalmaz. Kétértékű kationt tartalmazó növényvédőszerek reakcióba léphetnek a humuszanyag két különböző negatív töltésű helyével (pl. két karboxilát- ionnal vagy egy karboxilát- és egy fenolát-ionnal). Ugyanakkor nem minden negatív töltésű hely alkalmas a nagyméretű szerves kationok megkötésére, mivel felléphetnek sztérikus gátló hatások is. A bázikus peszticidek protonfelvétellel kationossá válhatnak a bázikusság mértékétől és a rendszer pH-jától függően. Ez a humuszanyagon lévő savas csoportok disszociációjának mértékét is befolyásolja.
A humuszanyagokon jelenlevő számos oxigén- és hidroxil-tartalmú funkciós csoport nagy valószínűséggel hidrogénhíd-kötések kialakulásához vezet a peszticidek megfelelő csoportjaival, habár a vízmolekulák erősen versengenek a peszticidekkel ugyanezekért a helyekért. A hidrogénhíd-kötés fontos szerepet játszik a humuszanyagokon való adszorpcióban a nemionos poláris peszticideknél, mint például az alaklór és a metolaklór.
A humuszanyagokon egyaránt jelenlevő elektronhiányos (pl. kinonok) és elektronfölösleggel rendelkező részek (pl. difenolok) elektron donor–akceptor mechanizmusok útján létrejövő töltésátvivő komplexek lehetséges kialakulását feltételezik, olyan peszticidekkel, amelyek elektron donor vagy elektron akceptor tulajdonsággal rendelkeznek.
Kovalens kötések kialakulását kémiai, fotokémiai vagy enzimatikus folyamatok katalizálják, ezáltal stabil, irreverzibilis kapcsolatok alakulhatnak ki a humuszanyag és a peszticidek, illetve elsősorban ez utóbbiak bomlása során keletkező közbülső, valamint végtermékek között.
A van der Waals-erők gyenge, rövid távú dipoláris vagy indukált dipoláris vonzások, amelyek csak részben fontosak a nemionos és nempoláris peszticideknek a humuszanyagok megfelelő helyén való adszorpciójakor. Mivel a van der Waals-erők összeadódnak, hozzájárulásuk az adszorpcióhoz a kölcsönható molekulák méretével és a humuszanyag adszorpciós kapacitásával nő.
Hidrofób adszorpció játszódik le a humuszanyagok hidrofób aktív helyei és nempoláris peszticidek között. A nempoláris peszticidek gyenge kölcsönhatásba lépnek a vízmolekulákkal, de a hidrofób kötőhelyeken a vízmolekulák nem képesek versengeni a növényvédőszer molekuláival. Ezek a kötőhelyek magas széntartalmú és kevés poláris csoporttal rendelkező alifás oldalláncokat vagy lipid-részeket és lignin-származék részleteket tartalmaznak. A hidrofób adszorpció fontos mechanizmus pl. a DDT és a metolaklór esetében. Ezt a fajta retenciót gyakran hidrofób szorpcióként említik [14], utalva arra, hogy a folyamat felfogható az oldószer és a felület közötti egyszerű megoszlásként. Ez a kölcsönhatás egyensúlyi folyamatként írható le, hasonlóan két nemelegyedő oldószer közötti megoszláshoz. Ez azt jelenti, hogy a humuszanyag mind a szilárd, mind pedig az oldat fázisban nem vizes oldószerként viselkedik, így a szerves vegyület a víz és a humuszanyag között oszlik meg.
Ehhez kapcsolódik a széles körben elfogadott ún. filmmodell [30] [31] is, amely a hidrofób természetű, nyomnyi mennyiségben jelenlevő anyagok vizes és szilárd fázis közötti megoszlását írja le. Az egyik fázist a víz, a másikat egy szerves filmréteg jelenti, ami a talajrészecskéket, illetve üledéket borítja. Tulajdonképpen maga a szerves
talajkomponens is adszorpció révén kötődik a poláris szervetlen komponens felületére, amelyen többé-kevésbé összefüggő filmszerű bevonatot képez.
Az alábbi alapvető megfigyelések fűződnek ehhez a modellhez:
a hidrofób vegyületek adszorpciós izotermáira az adott koncentráció- tartományban a linearitás jellemző;
adott vegyület esetén az adszorbeált mennyiség egyenesen arányos a talaj szervesanyag-tartalmával;
adott talaj illetve üledék esetén az adszorbeált mennyiség egyenesen arányos a szerves anyag oktanol−víz megoszlási hányadosával.
A filmmodellre a fenti szempontok alapján a (11) egyenlettel leírt összefüggés adható meg:
q = a · Kow · foc · c (11)
↓ K
ahol q a vegyület szilárd fázisbeli koncentrációja, a empirikus arányossági tényező, Kow
az oktanol−víz megoszlási hányados, foc a szilárd fázis szerves szén-tartalma, c a vegyület koncentrációja a vízben, K – az izoterma linearitásából következően – az adszorpciós koefficiens.
Senesi és munkatársai megvizsgálták az alaklór és a talaj, valamint az alaklór és a huminsavak között kialakult kölcsönhatásokat, amelyeket adszorpciós izotermák és különböző spektroszkópiai módszerek (pl. IR, ESR) segítségével értelmeztek [32].
Eredményeikből arra következtettek, hogy többféle kapcsolódási mód jöhet létre az alaklór adszorpciója során a molekula és a huminsav között. Hidrogénhíd-kötés alakulhat ki az alaklór karbonil O-je vagy amid N-je és a huminsav hidroxil és karboxil H-atomja között, valamint π−π kötések a huminsav elektron-donor aromás gyűrűi és az alaklór molekula elektron-akceptor aromás magja között.
Úgy ítélték meg, hogy az adszorpciós adatokra szerkesztett izotermák leginkább a Freundlich- és a Langmuir- egyenletek segítségével illeszthetők.
2.7. Analitikai módszerek
A kutatók különféle analitikai módszereket alkalmaztak a növényvédőszerek minőségi és mennyiségi meghatározására. Az anyagok mozgékonyságának tanulmányozására alkalmasnak bizonyult a vékonyréteg-kromatográfia [33] [34], hiszen ekkor nincs szükség pontos mennyiségi meghatározásra, elegendő az anyag jelenlétének megállapítása. Ennek a módszernek egy továbbfejlesztett változata a talajvékonyréteg- kromatográfiás vizsgálat [35], amelynek segítségével a növényvédőszerek adott talajon való mozgékonysága állapítható meg. A vizsgálatot különféle talajokkal elvégezve általános következtetést lehet levonni az egyes peszticidek mozgékonyságával kapcsolatban. Helling 5 mobilitási osztályba sorolja a peszticideket az elmozdulásukat kifejező HRf értékek alapján. Eszerint a 0–19 HRf értéket mutató növényvédőszerek az I., a 20–39 HRf értékűek a II., a 40–59 HRf értékűek a III., a 60–79 HRf értékűek a IV.
és a 80–100 HRf értékűek az V. mobilitási osztályba tartoznak. Károly G. és munkatársai Helling osztályozását alapul véve megállapították [36], hogy az I.
mobilitási osztályba tartoznak azok a hatóanyagok, amelyek a talajban a kijuttatás helyén maradnak, vagy csak rendkívül kismértékben mozdulnak el a talajrétegre jutó víz hatására. A II–III–IV. mobilitási osztályba tartozó hatóanyagok jellemzője az, hogy az eső-, ill. öntözővíz hatására kisebb-nagyobb mértékben elmozdulnak a talajban. Az V. mobilitási osztályba sorolt hatóanyagok jellemzője, hogy a hatóanyag egy része a talajrétegen a vízfronttal együtt mozdul el, így a mélyebb talajrétegbe történő lejutásának nagy a valószínűsége. A talajvékonyréteg-kromatográfiát alga bioteszttel kombinálva alkalmazták Helling és munkatársai [37], így a vizsgálat eredménye szemmel könnyebben követhető, mivel az algák igen érzékenyek a növényvédőszerekre.
Minőségi és mennyiségi meghatározásokra egyaránt alkalmasak a gázkromatográfiás mérések. Legyen szó akár a szer előállításakor szükséges hatóanyag- tartalom vizsgálatáról [38], akár növényekben vagy talajban való meghatározásról [39], vagy a szerek talajon való bomlásáról [40], a gázkromatográfiás módszer minden esetben alkalmazható. Hátránya a folyadékkromatográfiával szemben, hogy a mintaelőkészítés bonyolultabb, így több a hibalehetőség.
A növényvédőszerek vizsgálata során legtöbbször folyadékkromatográfiás elemzést alkalmaztak, egyéb detektálási módszerekkel társítva. Welther-Sándor és munkatársai a propizoklór stabilitását vizsgálták UV-besugárzás hatására [41]. A folyadékkromatográfiás (HPLC) analízis mellett gázkromatográfiás- tömegspektometriás (GC-MS) és termogravimetriás (TG) módszert is használtak, a bomlástermékeket azonosították. Nortrup gabonafélék vizsgálatakor a folyadékkromatográfia mellett elektrokémiai detektálást alkalmazott [42]. Ferrer és munkatársai herbicid metabolitok jelenlétét vizsgálták felszíni és talajvizekben [43]. A metabolitok azonosításához ionos természetük miatt gázkromatográfia nem használható, csak folyadékkromatográfia. Más vizsgálatokban HPLC-t és GC-MS-t egyaránt alkalmaztak az acetoklór folyóvízben és esővízben való meghatározásához [6]. A 2.6 fejezetben tárgyalt kísérletek során Senesi és munkatársai a mennyiségi meghatározást HPLC-vel végezték [32]. A herbicid és a talaj illetve a humuszanyagok közötti kölcsönhatásokat infravörös spektroszkópiás (IR), elektronspin-rezonanciás (ESR) és fluoreszcens fotometriás módszerrel tanulmányozták. Az adszorpciós kötések jellemzésére Farmer szintén ezt a módszert használta [44].
3. Célkitűzések
A Bevezetésből és az Irodalmi áttekintésből fény derült arra, hogy környezetvédelmi szempontból rendkívül fontos a növényvédőszerek adszorpciós sajátságainak vizsgálata, ami az első lépést jelenti e szennyezők talajban bekövetkező sorsának megismeréséhez. Az acetoklór és a propizoklór hazai gyártása és széleskörű mezőgazdasági felhasználása miatt e két vegyületet választottam példaként mint adszorptívumot, míg három hazai talajt és két talajalkotót (kvarc, montmorillonit) mint adszorbenst. Így célom az volt, hogy sztatikus egyensúlyi vizsgálatok kivitelezésével tanulmányozzam e két klór-acetanilid típusú vegyület adszorpcióját, majd az így kapott izotermákra egyenletet illesszek, hogy annak segítségével az adszorpcióra jellemző állandókat megállapítsam, és így fizikai magyarázatot találjak az általam vizsgált adszorpciós folyamatokra.
A munka kivitelezéséhez szükségem volt arra, hogy pontos és megbízható módszert találjak a klór-acetanilid típusú gyomirtószerekkel szennyezett vízminták tanulmányozására. Ezért választottam az összes szerves szén meghatározására alkalmas készüléket (TOC). Ez a módszer nem közismert ilyen jellegű minták vizsgálatánál, de egyszerűbb és olcsóbb az általánosan használt eljárásoknál (pl. GC, HPLC). A sztatikus egyensúlyi kísérletek vizes fázisának elemzéséhez az összes szerves szén meghatározásán alapuló nem specifikus módszer és az elválasztáson alapuló folyadékkromatográfiás vizsgálat összehasonlítását választottam.
Az adszorbens és az adszorptívum közötti kölcsönhatást infravörös spektroszkópiás vizsgálatok elvégzésével kívántam tanulmányozni.
A szerek stabilitásának ellenőrzése céljából bomlásvizsgálatokat hajtottam végre az adszorpciós kísérletek során alkalmazott körülmények között.
Végül szükségesnek tartottam a kapott eredmények és az ismert toxikológiai adatok összehasonlítását, mert ezek a szerek halakra erősen mérgezőek és ha talajhoz kötődnek, akkor a lejtőkről lemosódva felszíni vizeink közvetett szennyezését jelentik.
Közvetlen veszélyt jelent az a tény, hogy a Nitrokémia klór-acetanilid maradványokat is
tartalmazó kezelt szennyvize a Séd-Nádor-csatornába kerül, onnan pedig a Dunába folyik. A csatorna vizét öntözésre és halastavak táplálására is használják.
4. Kísérleti rész
4.1. Felhasznált anyagok
4.1.1. Reagensek, oldószerek
Az oldatokat minden esetben kétszer desztillált vízben (ioncserélt víz kálium- permanganát jelenlétében desztillálva) készítettem el. A különböző közegekhez felhasznált nátrium-nitrát (alt.), kálium-dihidrogén-foszfát (alt.) és dinátrium-hidrogén- foszfát (alt.) mindegyike a Reanal gyártmánya. A TOC mérésnél alkalmazott nátrium- peroxo-diszulfát (alt.) MERCK, a foszforsav (85%) pedig Interkémia Rt. gyártmány. A folyadékkromatográfiás elemzésekhez eluensként acetonitrilt (HPLC minőség) és tetrahidrofuránt (HPLC minőség) használtam, melyek közül az előbbi a Spektrum-3D, az utóbbi a MERCK terméke. Az extrahálószerként alkalmazott nagytisztaságú diklór- metánt és izo-oktánt ugyancsak a Spektrum-3D-n keresztül vásároltuk. Az infravörös felvételekhez a FLUKA AG-től szereztük be a szén-tetrakloridot és kálium-bromidot (mindkettő spektroszkópiai minőség).
4.1.2. Növényvédőszerek
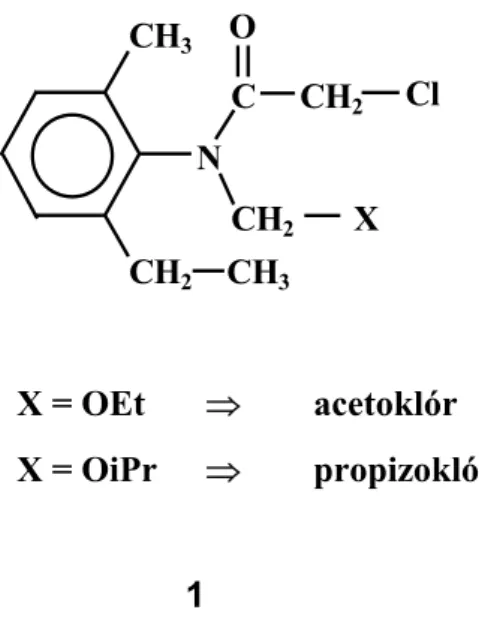
A kísérletekhez acetoklór és propizoklór standard-eket (99,3% és 98,2%) használtam, amelyeket a Nitrokémia 2000 Rt. bocsátott rendelkezésemre. A két anyag általánosan az 1 szerkezeti képlettel jellemezhető (6. ábra).
N
C CH2 O
Cl
CH2 X CH3
CH2 CH3
X = OEt ⇒ acetoklór X = OiPr ⇒ propizoklór
1
6. ábra: Az acetoklór és propizoklór szerkezeti képlete
Legfontosabb tulajdonságaik a Pesticide Manual szerint foglalhatók össze [45] az 1.
táblázatban.
1. táblázat : Az acetoklór és propizoklór legfontosabb tulajdonságai
Acetoklór Propizoklór Nevezéktan
Angol név Acetochlor Propisochlor
IUPAC név 2-chloro-N-ethoxymethyl-6'- ethylacet-o-toluidide
2-chloro-6'-ethyl-N-isopropoxy- methylaceto-o-toluidide
C. A. Név 2-chloro-N-(ethoxymethyl)-N- (2-ethyl-6-methylphenyl)- acetamide
2-chloro-N-(2-ethyl-6- methylphenyl)-N- [(methylethoxy)methyl]- acetamide
CAS RN [34256-82-1] [86763-47-5]
Fizikai-kémiai tulajdonságok
Molekulatömeg 269,8 g/mol 283,8 g/mol
1. táblázat folytatása
Acetoklór Propizoklór Molekulaképlet C14H20ClNO2 C15H22ClNO2
Forma kék-bíbor olaj világosbarnától a liláig terjedő színű olaj
Olvadáspont 0 °C 21,6 °C
Forráspont 162 °C/7 Hgmm 243 °C fölött elbomlik Gőznyomás 4,53 mPa (25 °C) 4 mPa (20 °C)
Sűrűség 1,1358 g/cm3 (20 °C) 1,097 g/cm3 (20 °C) Oldhatóság 223 mg/l víz (25 °C).
Oldható dietil-éterben, acetonban, benzolban,
kloroformban, etanolban, etil- acetátban és toluolban.
184 mg/l víz (20 °C).
Oldható a legtöbb szerves oldószerben.
log Kow 3,03 3,5
Stabilitás több, mint 2 évig stabil 20°C-on EC formában.
(nincs adat)
Lobbanáspont >110 °C 175 °C
Felhasználás
Hatás szelektív herbicid; a
fehérjeszintézis gátlásán keresztül fejti ki hatását
elsődlegesen a csírázó növény hajtásain, másodlagosan annak gyökerén keresztül szívódik fel
a csírázó növény hajtásain szívódik fel, gátolja a fehérjeszintézist a rá érzékeny növényekben
Használat egynyári füvek, bizonyos széles levelű gyomok ellen használják
kukorica, földimogyoró, szójabab, gyapot, burgonya és
cukornád ültetvényeken
csírázás illetve szárba szökkenés előtt, bizonyos egynyári füvek és széles levelű gyomok ellen, kukorica, napraforgó, szójabab, burgonya és borsó ültetvényeken
1. táblázat folytatása
Acetoklór Propizoklór
Forma típus EC EC
Kompatibilitás kompatibilis más herbicidekkel és folyékony trágyákkal
(nincs adat)
Márkanevek “Harness Plus” (Monsanto),
“Surpass” (Zeneca), “Trophy”
(Zeneca), “Acenit 50EC”,
“Acenit 500EC” (Nitrokémia 2000)
“Proponit” (Nitrokémia 2000)
Keverékek acetoklór+atrazin (nincs adat)
Analízis GC és HPLC GLC és HPLC
Emlős toxikológia
Akut orális LD50 2148 mg/kg hím patkányra 3433 mg/kg, nőstény patkányra 2088 mg/kg Akut dermális
LD50
4166 mg/kg. Szemirritatív.
Közvetlen érzékenységi reakciók tengerimalacokon.
patkányra >2000 mg/kg
Inhalációs LC50 patkányra >3,99 mg/l levegő (4 óra)
patkányra >5 mg/l levegő
NOEL patkányra (2 év) 10 mg/kg/nap;
kutyára (1 év) 12 mg/kg/nap
patkányra (90 nap) 250 mg/kg/nap
ADI-érték 0,01 mg/kg/nap 2,5 mg/kg/nap
Toxicitási osztály (nincs adat) WHO III.
Ökotoxikológia
Madarak akut orális LD50 fürjre
1590 mg/kg (5 nap), LC50 fürjre és vadkacsára >5620 mg/kg
akut orális LD50 vadkacsára 2000 mg/kg, japán fürjre 688 mg/kg. Nyolc napos LC50
vadkacsára és fürjre 5000 mg/kg
![A peszticidek kijuttatás utáni sorsát mutatja az 2. ábra [4]:](https://thumb-eu.123doks.com/thumbv2/9dokorg/873551.46994/15.892.174.759.538.1078/peszticidek-kijuttatás-utáni-sorsát-mutatja-ábra.webp)