FLUORIDION ICP-AES MÓDSZERREL TÖRTÉNŐ INDIREKT MEGHATÁROZÁSA ÉS A LEJÁTSZÓDÓ REAKCIÓK KOMPLEX ANALITIKAI VIZSGÁLATA
Doktori (PhD) értekezés
Készítette:
Kovács Máté
Témavezető:
Dr. Halmos Pál tudományos főmunkatárs
Pannon Egyetem
Kémiai és Környezettudományi Doktori Iskola
Analitikai Kémia Intézeti Tanszék Veszprém
2010
- 3 -
FLUORIDION ICP-AES MÓDSZERREL TÖRTÉNŐ INDIREKT
MEGHATÁROZÁSA ÉS A LEJÁTSZÓDÓ REAKCIÓK KOMPLEX ANALITIKAI VIZSGÁLATA
Értekezés doktori (PhD) fokozat elnyerése érdekében Írta:
Kovács Máté
Készült a Pannon Egyetem Kémiai és Környezettudományi Doktori Iskolájának keretében
Témavezető: Dr. Halmos Pál
Elfogadásra javaslom (igen / nem) ……….
(aláírás) A jelölt a doktori szigorlaton …... % -ot ért el,
Az értekezést bírálóként elfogadásra javaslom:
Bíráló neve: …... …... igen /nem
……….
(aláírás) Bíráló neve: …... …... igen /nem
……….
(aláírás) A jelölt az értekezés nyilvános vitáján …...% - ot ért el
Veszprém, ……….
a Bíráló Bizottság elnöke A doktori (PhD) oklevél minősítése…...
Veszprém, ………
Az EDT elnöke
- 4 - Tartalomjegyzék
KIVONAT ...7
ABSTRACT ...8
ZUSAMMENFASSUNG ...9
1. BEVEZETÉS ...10
2. IRODALMI ÁTTEKINTÉS ...12
2.1.A FLUOR JELLEMZÉSE ... 12
2.2.A FLUOR ELŐFORDULÁSA A TERMÉSZETBEN ... 13
2.3.A FLUOR ÉS VEGYÜLETEINEK FELHASZNÁLÁSA ... 13
2.4.A FLUORIDION HATÁSA AZ EMBERI SZERVEZETRE ... 14
2.5.ANALITIKAI MÓDSZEREK FLUOR MEGHATÁROZÁSÁRA ... 14
2.5.1. Nem atomspektroszkópiai módszerek ... 14
2.5.2. Atomspektroszkópiai módszerek ... 16
2.6.AZ ICP-AES MÓDSZER ... 18
2.7.ATOMSPEKTROSZKÓPIAI MÓDSZEREK AUTOMATIZÁLÁSA ... 20
2.8.A CÉRIUM(III)ION FLUORIDIONNAL ÉS SZULFÁTIONNAL ALKOTOTT KOMPLEXEINEK VIZSGÁLATA ... 20
2.9.A CÉRIUM(III)ION FLUORO-KOMPLEXEINEK FOTOFIZIKAI VIZSGÁLATA ... 26
2.10.A CÉRIUM(III)-FLUORID JELENTŐSÉGE ... 29
2.11.CÉRIUM(III)-FLUORID NANORÉSZECSKÉK ELŐÁLLÍTÁSA ÉS TULAJDONSÁGAIK... 30
2.12.NANORÉSZECSKÉK VIZSGÁLATI MÓDSZEREI ... 30
Zéta-potencál mérés ... 32
Röntgendiffraktometria ... 33
Elektronmikroszkópia... 33
Rezgési spektroszkópia (infravörös és Raman-spektroszkópia) ... 34
Termikus analízis ... 34
UV-látható spektrofotometria és spektrofluorimetria ... 34
3. CÉLKITŰZÉS ...36
4. KÍSÉRLETI RÉSZ ...38
4.1.A KÍSÉRLETI MUNKA SORÁN FELHASZNÁLT VEGYSZEREK ... 38
4.2.A KÍSÉRLETI MUNKA SORÁN HASZNÁLT KÉSZÜLÉKEK ÉS ANALITIKAI MÓDSZEREK ... 39
4.3.A FLUORIDION MEGHATÁROZÁSÁHOZ ALKALMAZOTT ANALITIKAI MÓDSZEREK ... 42
4.4.A FLUORIDION ICP-AES MEGHATÁROZÁSÁHOZ VÉGZETT KÍSÉRLETEK ... 43
4.5.A MEGHATÁROZÁS SORÁN LEJÁTSZÓDÓ REAKCIÓK VIZSGÁLATA ... 44
- 5 -
4.5.1. UV-látható spektrofotometriás, spektrofluorimetriás és fotofizikai vizsgálatok ... 44
4.5.2. Részecskeméret eloszlás és zéta potenciál mérések... 47
4.5.3. Nanorészecskék előállítása és vizsgálata ... 47
5. EREDMÉNYEK ...48
5.1.ANALITIKAI MÓDSZER FEJLESZTÉSE FLUORIDION ICP-AES MEGHATÁROZÁSÁHOZ ... 48
5.1.1. A csapadékképző fémion kiválasztása... 49
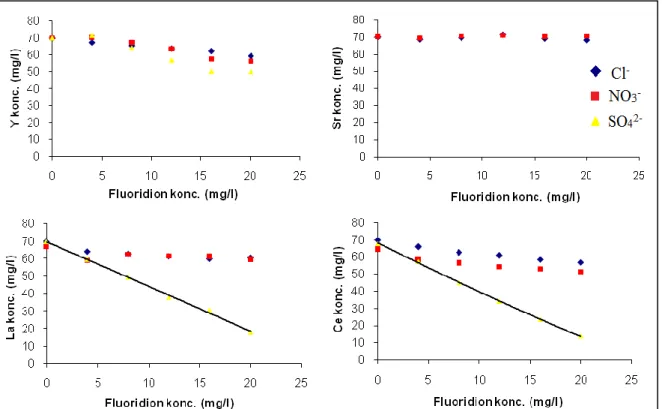
5.1.2. A szulfátionok hatása ... 51
5.1.3. Reakcióidő megválasztása, oldatstabilitás ... 52
5.1.4. Optimális koncentráció-tartomány kiválasztása... 53
5.1.5. Robusztusság ... 59
5.1.6. Specifikusság... 61
5.1.7. Ajánlott módszer fluoridion ICP-AES technikával történő indirekt meghatározásához ... 62
5.1.8. Torzítatlanság ... 63
5.1.9. Validálási összefoglaló a manuális módszerhez ... 65
5.2.AZ INDIREKT ICP-AES FLUORIDION MEGHATÁROZÁS AUTOMATIZÁLÁSA ... 67
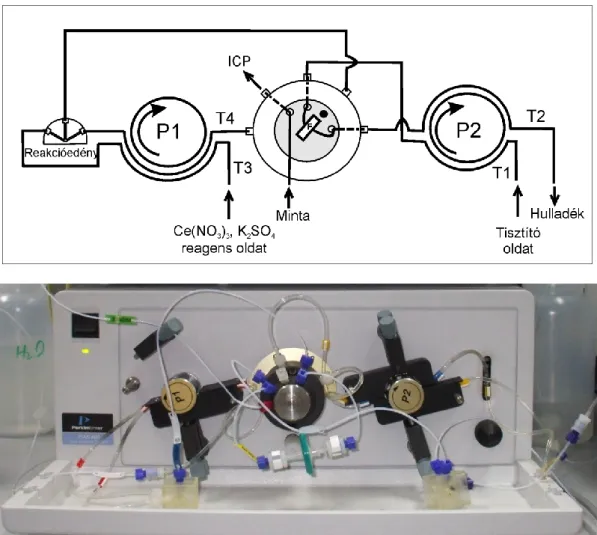
5.2.1. A mintaelőkészítő egység felépítése ... 68
5.2.2. A FIAS rendszer működése ... 71
5.2.3. Az ICP-AES mérés kivitelezése az on-line módszer során ... 72
5.2.4. Módszer adaptálás / Optimálás ... 74
5.2.4.1. Off-line módszer optimálása ... 74
5.2.4.2. On-line módszer optimálása ... 77
5.2.5. Az automatikus módszer torzítatlanságának vizsgálata ... 79
5.2.6. Validálási összefoglaló az automatizált módszerhez ... 80
5.2.7. A manuális és az automatizált módszer összehasonlítása ... 81
5.3.A MEGHATÁROZÁS SORÁN LEJÁTSZÓDÓ REAKCIÓK VIZSGÁLATA ... 82
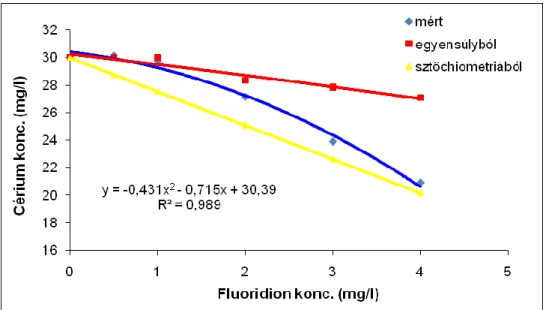
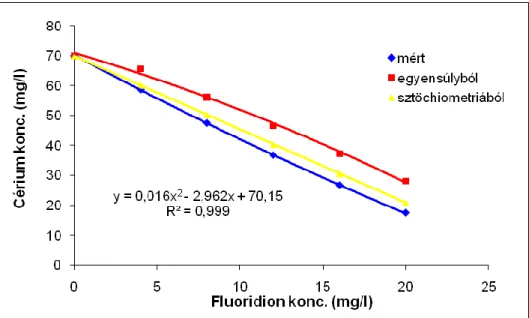
5.3.1. Cérium(III)ion fluoridionnal történő komplexálódásának vizsgálata ... 82
5.3.2. Cérium(III)ion szulfátionnal történő komplexálódásának vizsgálata... 87
5.3.3. A komplexképzési reakciókról szerzett információk helyességének igazolása ICP-AES spektrometriával ... 89
5.3.4. A cérium(III)-fluoro komplexek és a cérium(III)-fluorid fotofizikai vizsgálata ... 90
5.4.5. Cérium(III)-fluorid nanorészecskék analitikai vizsgálatának eredményei ... 102
5.4.5.1. Részecskeméret és zéta-potenciál analízis... 102
5.4.5.2. Morfológia (fény- és elektronmikroszkópia) ... 105
5.4.5.3. Összetétel vizsgálat (SEM-EDX és röntgendiffrakciós mérések) ... 107
5.4.5.4. Termikus vizsgálat ... 108
5.4.5.5. UV-látható spektroszkópia és spektrofluorimetria ... 109
5.4.5.6. Rezgési spektroszkópia (Infravörös- és Raman-spektrometria) ... 111
5.4.5.7. Az analitikai eredmények összefoglalása ... 115
- 6 -
6. ÖSSZEFOGLALÁS ... 116
7. IRODALOMJEGYZÉK ... 119
8. DOKTORI (PHD) ÉRTEKEZÉS TÉZISEI ... 131
9. THESIS ... 134
10. TUDOMÁNYOS MUNKA ... 137
Publikációk ... 137
A dolgozathoz kapcsolódó konferencia előadások, poszterek... 138
A dolgozathoz nem kapcsolódó konferencia előadás ... 139
11. KÖSZÖNETNYILVÁNÍTÁS ... 140
- 7 -
K
IVONATAtomspektroszkópiai módszert fejlesztettem ki fluoridion koncentrációjának közvetett meghatározására. A meghatározás során ismert mennyiségben a mintához feleslegben adott cérium(III)ionokkal kötjük meg csapadékképződés során a fluoridionokat és a visszamaradt cérium(III)ionok mennyiségét atomspektroszkópiai módszerrel határozzuk meg. A módszer kiválóan alkalmas talajvizek és nagy fluoridtartalmú veszélyes hulladékok fluorid-koncentrációjának meghatározására. A módszer egyszerűbb, gyorsabb, kisebb vegyszer szükségletű, és megbízhatóbb eredményt ad nagy mátrix koncentrációjú minták esetében, mint az általánosan használt módszerek (potenciometria ionszelektív elektród használatával, ionkromatográfia). A módszer további előnye, hogy a fémionok koncentrációjának meghatározása előtt ‒ vagy azt követően ‒ ugyanazzal a készülékkel elvégezhető a fluoridion meghatározása is. A kidolgozott módszert automatizáltam, így a mintaelőkészítés lerövidült és a vizsgálat munkaigényessége is csökkent.
Vizsgáltam a cérium(III)-fluorid csapadékképződési reakcióját szulfátionok jelenlétében.
Megállapítottam, hogy a reakcióban nanoméretű részecskék keletkeznek, melyek koagulálását a szulfátionok azáltal segítik elő, hogy a nanorészecskék felületére kötődő dihidroxo-cérium(III) komplexekkel kelát-típusú külsőszféra komplexet alkotnak, csökkentve ezzel a nanorészecskék felületi töltését. Így alkalmas lehet a módszer ipari méretekben cérium(III)-fluorid nanorészecskék előállítására. Tanulmányoztam a részecskék keletkezésének mechanizmusát, illetve az előállított nanorészecskéket teljeskörű analitikai vizsgálatnak vetettem alá a szerkezet és az összetétel megállapításának céljából.
A csapadékképződési reakció UV-látható spektrofotometriai vizsgálata során a cérium(III)- és a fluoridionok között lejátszódó komplexálódást is mélyrehatóan tanulmányozhattam. Meghatároztam a cérium(III)-fluoro komplexek stabilitási állandóit, és elsőként jellemezhettem az egyedi elektrongerjesztési sajátságaikat fényelnyelési, illetve fénykisugárzási oldalról is.
- 8 -
A
BSTRACTIndirect determination of fluoride by ICP-AES and the multi-analytical approach of the occured reactions
An atomic spectroscopic method was developed for indirect determination of fluoride concentration. According to the method an excess of known amount of cerium(III) ions is added to the sample in order that the fluoride ions could be precipitated and then the excess of cerium(III) is determined by atomic spectroscopic method. The method is excellent for determination of fluoride in groundwater and hazardous wastes of high fluoride content.
The method is simpler, faster, demands less reagent and gives more accurate results to analyse samples of high-matrix concentration than the common methods (e.g.
potentiometric determination using ion selective electrode, ion chromatography).
Additional advantage of the method is that the determination of fluoride concentration of the sample can be executed directly before or after the analysis of metal ions in the sample using the same instrument. The method was automatized in order to achieve shorter sample-preparation time and less manual work of the determination.
The precipitation reaction of cerium(III) fluoride in the presence of sulphate ions was investigated. The particles formed in the reaction are in the nano size range, the coagulation of the nano particles is enhanced by sulphate ions in such a way that the sulphate forms an outer-sphere chelate-type complex with dihydroxo cerium(III) complexes which are bonded on the surface of nano particles decreasing their surface charge. Accordingly, the method can be suited for manufacture cerium(III) fluoride nano particles at industrial-scale. The mechanism of the nano particle formation was studied and the nano particles were examined by different analytical techniques in order to determine the structure and the composition of the nano particles.
The complexation between cerium(III) and fluoride ions beside the investigation of the precipitation reaction by UV-Vis spectrophotometry was extensively studied. The stability constants of the cerium(III)-fluoro species were determined and their electronic excitation features were characterised by absorption and emission approach as well.
- 9 -
Z
USAMMENFASSUNGIndirekte Bestimmung von Fluoridionen mit der ICP-AES Methode und die komplex analytische Untersuchung der erfolgenden Reaktionen
Eine neue Methode für die indirekte Bestimmung der Konzentration des Fluoridions wurde entwickelt. Während der Bestimmung werden Cerium(III)-Ionen in gekannter Menge überschießend dem Muster zugegeben, um die Fluoridionen in einer Niederschlag bildende Reaktion anzubinden und die Quantität der zurückbleibenden Cerium(III)-Ionen werden mit atomspektroskopischer Methode bestimmt. Diese Methode ist für das Gehalt an Fluoriden des Bodenwassers und Sondermülls vorzüglich geeignet. Die Methode braucht die Chemikalien in niedriger Menge, sie ist einfacher, schneller und liefert verlässlicheres Ergebnis im Fall der Muster mit großer Matrix-Konzentration als die Methoden in allgemeinem Gebrauch (Ionchromatographie, Potentiometrie mit ionselektiver Elektrode). Der additionale Vorteil der Methode ist es, dass die Bestimmung der Fluoridionen vor oder nach der Bestimmung der Konzentration der Metallionen mit demselben Gerät möglich ist. Die entwickelte Methode wurde automatisiert, damit wurde es erreicht, die Vorbereitungsarbeiten des Musters zu verkürzen und den Arbeitsbedarf der Testen zu verringern.
Die Niederschlag bildende Reaktion von Cerium(III)- Fluorid in Anwesenheit der Sulfationen wurde untersucht. Es wurde festgestellt, dass während der Reaktion Nanoteilchen entstehen, deren Koagulation von Sulaftionen dadurch befördert wird, dass die Sulfationen mit den Cerium(III)- Dihydroxokomplexen, die auf der Oberfläche der Nanoteilchen anbinden, einen außensphärischen Kelatkomplex bilden. Durch diesen Prozess wird die Oberflächenladung der Nanoteilchen gesenkt. Diese Eigenschaft macht es möglich, auch in industriellem Mass Cerium(III)-Fluorid Nanoteilchen zu erzeugen. Auch der Entstehungsprozess der Teilchen wurde studiert, und die Nanoteilchen wurden mit dem Ziel der Bestimmung ihrer Zusammensetzung und Struktur analytisch untersucht.
Während der im sichtbaren UV Bereich ausgeführten spektrophotometrischen Testen der Niederschlagreaktion konnte auch die Komplexbildung zwischen Cerium(III) und Fluoridionen studiert werden. Die Stabilitätskonstanten der Cerium(III)- Fluorokomplexen wurden festgestellt, und ich war der Erste, der ihre individuellen Eigenschaften der Elektronenerregung aus Seiten von Lichtabsorption und Lichtemission charakterisiert hat.
- 10 -
1. B EVEZETÉS
Napjainkban egyre nagyobb szerepet kap a környezeti analitika. A különféle szennyezők koncentrációjának a legváltozatosabb mátrixokban történő meghatározására számos analitikai módszer került kifejlesztésre. A minták eredetének, összetételének, a főalkotók és szennyezők koncentrációjának változatossága nagy kihívás elé állítja az analitikust, amikor sokszor a g/l vagy ng/l nagyságrendben jelenlevő szennyezők koncentrációját kell meghatároznia.
Az utóbbi időben megfigyelhető az analitikai kémiában az a tendencia, hogy vizsgálati módszereket fejlesztenek ki olyan technikákat alkalmazva, amelyek eredendően nem megfelelőek az alkotó (szennyező) meghatározására. Ha a teljesítményjellemzőket tekintve nem is jár jelentős előnnyel az új módszer, alkalmazásának inkább praktikus okai vannak, hiszen ha egy laboratórium nem rendelkezik a meghatározáshoz alkalmas készülékkel, akkor sem kell másik laboratóriumot keresni. Így sok esetben időt és akár pénzt is megtakaríthat a cég, illetve a minták szállításából eredő összetételbeli változások is elkerülhetők.
Az atomspektroszkópiai módszerek kiválóak fémek, félfémek és néhány nem-fém meghatározására. Az induktív csatolású plazma – atomemissziós spektrometria (ICP-AES) kitűnő érzékenységet, széles lineáris tartományt és specifikusságot biztosít a periódusos rendszer mintegy 70 elemének meghatározására. A halogéneket tekintve a rendszám csökkenésével az emissziós hullámhosszak egyre csökkennek, így a klór és a fluor emissziója már a vákuum-ultraibolya tartomány alsó régiójába esik. A megvásárolható legmodernebb készülékek képesek mérni a klórt 134 nm hullámhossznál található emissziós vonalán, de a fluor esetében egyéb problémákba is ütközünk: az alkalmazott argon plazma nem képes megfelelő energiát biztosítani a gerjesztéséhez.
Felfigyeltem arra, hogy a meghatározás során keletkező cérium(III)-fluorid részecskék méretét jelentősen befolyásolja az oldatban jelenlevő egyéb ionok minősége és koncentrációja. Megállapítottam, hogy a részecskék átmérője a nanométer tartományba esik, így a PhD munkám új irányvonalat kapott, amelyben a nanorészecskék képződése, aggregációjuk tanulmányozása és összetételük felderítése is szerepelt.
A nanorészecskék szerepe folyamatosan növekedett az elmúlt 50 év során. A nanotechnológia létezését Feynman 1959-es széles körben ismert „Lenn bőven van hely”
- 11 -
című beszédétől számítjuk, ahol először került szóba egy új tudomány- és iparág keletkezése, amely az anyagok és tulajdonságaik atomi szinten történő irányításával foglalkozik. További 30 évnek kellett eltelnie ahhoz, hogy a tudományos közösség valóban a nanotudományra terelje figyelmét. A nanorészecskék terjedő felhasználása annak köszönhető, hogy eltérő tulajdonságokkal rendelkeznek, mint a nagyobb részecskeméretű azonos anyagok. Előállításuk viszont sokszor meglehetősen bonyolult, ezért költséges.
Számos kutatócsoport céljai között szerepel olcsóbb, egyszerűbb módszerek kidolgozása nanorészecskék előállítására és felhasználásuk kiterjesztésére.
A nanorészecskék UV-látható spektrofotometriával történő vizsgálatai során figyeltem fel arra, hogy a cérium(III)ion fluoro-komplexei ezzel a módszerrel kiválóan vizsgálhatóak, viszont ezek stabilitási állandóit eddig csak elválasztási és elektrokémiai módszerekkel vizsgálták, amelyek csak közvetett információt képesek szolgáltatni a stabilitási állandók megállapításához. A bíztató kísérleti eredmények alapján további vizsgálatokat végeztem a fluoro-komplexek és a cérium(III)-fluorid fotofizikai tanulmányozásához.
- 12 -
2. I RODALMI ÁTTEKINTÉS
2.1. A fluor jellemzése
A fluor a VII. fõcsoport 2. periódusának eleme, a halogének első tagja. Sárgás-zöld színű, szobahőmérsékleten gáz halmazállapotú. Rendkívül nagy elektronegativitásának köszönhetően, igen reaktív, ebből következik maró, mérgező és oxidatív tulajdonsága.
Elemi állapotban kétatomos molekulát képez, a természetben reakcióképessége miatt ebben a formában nem található meg, szinte minden elemmel könnyen reagál. Az 1. táblázat foglalja össze a fluor főbb fizikai tulajdonságait [1].
1. táblázat
A fluor fizikai és kémiai tulajdonságai
Rendszám 9
Atomtömeg 18,9984 g/mól
Sűrűség (0 °C, 101,325 kPa) 1,7 g/l Elektronkonfiguráció 1s2 2s2 2p5
Atomrádiusz 50 pm
Olvadáspont 53,53 K
Forráspont 85,03 K
Oxidációfok -1
Elektronegativitás (Pauling-féle) 3,98
Neve a folypát (más néven fluorit, CaF2) latin nevéből származik, fluor lapis (fluere = folyni). A folypátot már a középkorban folyósító szerként alkalmazták a kohászatban. A folypát legnagyobb előfordulása Afrikában és Európában van. A fluor egyik legjelentősebb ásványát a fluoritot elsőként Agricola írta le 1530-ban. Később Schwanhard, Carl Wilhelm Scheele, Humphry Davy, Caroline Menard, Gay-Lussac, Antoine Lavoisier, és Louis Thenard is foglalkozott a fluorittal és a belőle előállított hidrogén-fluoriddal. A fluort mint kémiai elemet Henri Moissan állította elő 1886-ban, amiért később, 1906-ban kémiai Nobel-díjat kapott [2].
- 13 -
2.2. A fluor előfordulása a természetben
A fluor a természetben vegyületei formájában található meg. Legjelentősebbek ezek közül a fluorit, a kriolit (Na3AlF6) és a fluorapatit (Ca5(PO4)3F) [3]. Szignifikáns antropogén forrása az alumíniumolvasztás és a foszfátműtrágyák, melyek foszforit tartalmuknak köszönhetően 3 – 3,5 m/m % fluort tartalmaznak [4]. A talaj- és felszíni vizekben a fluoridion koncentráció 1 mg/l alatt van [5]. A tengervíz 1,3 mg/l, az édesvizek kb. 0,2 mg/l fluoridiont tartalmaznak [6,7].
2.3. A fluor és vegyületeinek felhasználása
A fluort legnagyobb mennyiségben az ipar két igen meghatározó termékénél használják fel. Mérgezősége ellenére kiváltása más technológia alkalmazásával még nem sikerült.
Egyik felhasználása elemi állapotban történik az 235U izotóp dúsításához. Ehhez az uránt fluorral reagáltatják, mely reakció során urán-hexafluorid keletkezik, amely könnyen elpárologtatható és így az effúzión alapuló elválasztás kivitelezhető. Az effúziós dúsításnál léteznek korszerűbb technológiák is, de ezek mindegyikében szintén urán-hexafluoridot alkalmaznak.
A legnagyobb mennyiségben a fluoridot kriolit formájában használják fel az alumíniumgyártás folyamán. A kriolit az alumínium-oxid olvadását könnyíti meg, így az olvadék elektrolízise alacsonyabb hőmérsékleten lehetséges. Az alumínium előállítása során rendkívül nagy mennyiségű fluorid (és nem utolsó sorban cianid) tartalmú veszélyes hulladék keletkezik, amelyek feldolgozása, tárolása sem egyszerű.
A fluor vegyületeinek további felhasználása: hidrogén-fluorid üvegmaratáshoz, a széles körben elterjedt teflon, amely fluorozott szénhidrogén-polimer, a freonok, melyeket korábban hűtőgépek hőszállító közegeként használtak, de a szigorú környezetvédelmi előírásoknak köszönhetően felhasználásuk visszaszorult, a gyógyszeriparban érzéstelenítők, antibiotikumok, gombaölőszerek, rákellenes – kemoterápiás – gyógyszerek tartalmaznak fluoratomot. A fluorozott gyógyszerhatóanyag-molekulák szintézise virágkorát éli. A fluor fontos vegyülete a nátrium-fluorid, melyet fogkrémekben alkalmaznak nagy mennyiségben (szinte mindegyik fogkrém kb. 0,1 % koncentrációban tartalmaz nátrium-fluoridot, viszont hatásosságát mostanában megkérdőjelezik), illetve rovarirtóként is hatásos. A hidrogén- fluoridot előszeretettel használják fertőtlenítőszerekben pl.: mosodákban, sörfőzdékben [8].
- 14 -
2.4. A fluoridion hatása az emberi szervezetre
A fluor fontos eleme a csontok ásványi anyagának, a fluorapatit (Ca5(PO4)3F) képződésénél, és a fogzománc felépülésénél van jelentősége. Amíg a fogak növekednek az embernek napi 1,8 mg a fluorid szükséglete. A fogak és csontok kb. 0,001 m/m % fluort tartalmaznak [7]. Ezért kis koncentrációban adalékként alkalmazzák fogkrémben és más gyógyszerekben. Az emberi fog és csontnövekedés jelentősége miatt a fluort néhány országban az ivóvízhez adják. Számos országban viszont a csapvízfogyasztás nem jelentős, illetve a fluoridionok képesek komplexet képezni több fémionnal, így azok biológiailag aktívvá válnak, ezért csak kevés helyen alkalmazzák az ivóvíz fluoriddal való dúsítását [3].
Sok fluorvegyület mérgező. 0,01 m/m %-ban már felfedezhető a fluor káros hatása, ezért a maximális munkahelyi koncentrációja nem érheti el a 10-5 m/m %-ot. Nagyobb koncentrációban az embernél fogzománc elváltozásokat, hajhullást, bőrkiütést és más típusú egészségkárosodást okozhat [7,9].
A fluoridot 1972-ben sorolták az esszenciális elemek közé [10]. A fluor azok közé az elemek közé tartozik, amelyek csak egy nagyon szűk (biooptimális) koncentráció tartományban hasznosak, ezért a fluor pozitív hatása gyorsan átfordul mérgező hatássá [10].
Az ivóvízben a fluoridion koncentrációjának határértéke az Európai Unióban 1,5 mg/l, az Egészségügyi Világ Szervezet (WHO) ajánlása 1 mg/l.
2.5. Analitikai módszerek fluor meghatározására 2.5.1. Nem atomspektroszkópiai módszerek
A szakirodalomban számos példát találunk fluoridion koncentrációjának meghatározására, habár ezek többsége nem terjedt el általánosan, nehéz alkalmazhatóságuk vagy éppen a rossz specifikusságuk miatt. Régebben gyakran használták a fluoridionok desztillációját tömény foszforsavas – kénsavas közegben, hogy megszabaduljanak a mátrixtól. Az erősen savas közegben a fluoridion hidrogén-fluoriddá alakul, amely melegítés hatására eltávozik az oldatból, így abból kidesztillálható és nátrium-hidroxid oldatban elnyelethető. A módszer nem csak bonyolult, de időigényes is [11,12].
A Magyar Szabvány fluoridion koncentrációjának meghatározására potenciometrikus módszert ír elő, míg a modern HPLC-vel felszerelt laboratóriumok a megbízhatóbb ionkromatográfiát választják alternatívaként [13,14]. Mostanában nagy figyelmet kap a
- 15 -
kapilláris elektroforézis is, mellyel könnyedén, rendkívül rövid analízis idővel határozható meg a mintából egyszerre nem csak a fluoridion, hanem több más ion koncentrációja is.
Az igen népszerű – és viszonylag költségkímélő – potenciometriás meghatározás során egy fluoridion-szelektív elektród (ISE), és egy referencia elektród (kalomel vagy ezüst/ezüst-klorid elektród) közötti potenciálkülönbséget mérik. Az ionszelektív elektróddal történő mérésnek két típusa van: az egyiknél ismert fluoridion koncentrációjú oldatokkal hitelesítő egyenest vesznek fel, majd a minta esetében mért potenciálkülönbségből számítják a minta fluoridion koncentrációját. A módszer másik típusa az addíciós meghatározások elvén alapul: ismert koncentrációjú fluoridion oldat részleteit adagolják a mintához, és a potenciálkülönbségeket ábrázolják a koncentráció függvényében. A minta koncentrációját a mérési pontokra illesztett egyenes metszi ki a koncentrációtengely negatív tartományában [15]. Az elektrokémiai módszereknél leginkább jelentkező problémát, az ionerősség beállítását egy TISAB (Total Ionic Strength Adjustment Buffer) elnevezésű CDTA-t (ciklohexil-amino-dinitril-tetraacetát), nátrium- hidroxidot, nátrium-kloridot és ecetsavat tartalmazó oldattal végzik. Az ionerősség jelentősen befolyásolja a mérhető potenciálkülönbséget, amit a TISAB oldat megnövel, amely ezáltal olyan tartományba kerül, hogy a standard oldat és a mintaoldatok közti eltérés elhanyagolhatóvá válik. Továbbá alkalmas bizonyos zavaró ionok maszkírozására is [16]. A módszer alkalmazására az irodalomban számos példát találunk: Sarudi és munkatársai magyar ivóvizek és ásványvizek fluoridtartalmát határozták meg [17]. Tafu és munkatársai egyedi eljárást alkalmaztak a fluoridion dúsítására, majd a fluoridion koncentrációjának meghatározását ugyancsak fluorid-szelektív elektróddal végezték el [18].
A méltán népszerű elválasztási módszerek – nagyteljesítményű folyadékkromatográfia és kapilláris elektroforézis – legnagyobb előnye és egyben nagy hátránya is, hogy számos komponens meghatározható egyetlen mérés során, viszont a mérés idejét az határozza meg, hogy mikor távozik a detektorban jelet adó utolsó komponens az oszlopról, illetve a kapillárisról. Utóbbi módszer esetében ez jelentősen lerövidül. További problémát vetnek fel a nagy mátrix koncentrációjú vagy nagyon savas minták, ilyenkor több előkísérlet és hosszadalmas mintaelőkészítés után végezhető el csak az elemzés. Ionkromatográfia esetében jól alkalmazható szupresszálást követően a vezetőképességi detektálás [19-21], míg kapilláris elektroforézisnél az indirekt spektrofotometriás detektálás terjedt el [22,23].
Kevésbé elterjedt, de említést érdemlő módszerek a spektrofotometriára [24-27], indirekt potenciometriára és neutronaktivációs analízisre épülő meghatározások. Hayashi
- 16 -
és munkatársai spektrofotometriás fluoridion meghatározást dolgoztak ki. A módszerrel 2-200 mg/l koncentráció tartományban ± 2%-os pontosságot értek el. Ebben a tartományban szulfát-, klorid- és nitrátionok nem zavarták a meghatározást. Ennek a módszernek az alkalmazásával leírták szerves vegyületek fluor-tartalmának meghatározását is [28]. Ismeretes a fluor radioanalitikai módszerekkel történő meghatározása is, például neutronaktivációs analízissel [29]. Ez a lehetőség leginkább szilárd minták mérésére terjedt el, de viszonylag kis szerephez jut.
2.5.2. Atomspektroszkópiai módszerek
Az atomspektroszkópia történetét, 1859-től számítjuk, amikor megjelent Kirchhoff és Bunsen közleménye, melyben a Wollaston által megalkotott első spektroszkóp továbbfejlesztését közlik, mellyel felfedezték színképvonalaik segítségével a céziumot és rubídiumot. Ezt követően az elmúlt 150 évben jelentős fejlődésnek indult az optikai atomspektroszkópia, és számos külön ágra vált szét:
- atomemissziós spektroszkópia (AES) - atomabszorpciós spektroszkópia (AAS) - atomfluoreszcens spektroszkópia (AFS).
Nem optikai spektroszkópiai, de tudománytörténeti okokból az atomspektroszkópiai módszerek közé sorolt elemanalitikai módszer az induktív csatolású plazma – tömeg spektrometria (ICP-MS) is [30].
A kutatóknak mindig is nagy kihívást jelentett atomspektroszkópiai módszerrel a fluor / fluoridion koncentrációjának meghatározása, mivel a fluoratom gerjesztéséhez több mint 12,7 eV energia szükséges, így a rezonáns vonalak a 100 nm alatti vákuum- ultraibolya tartományba esnek. Ennek a tartománynak a megfigyelését nehezíti, hogy az alkalmazott üveg optikai eszközök (lencsék), és az atmoszféra elnyelik a sugárzást, illetve a detektorok érzékenysége is gyenge. Ezen kívül az induktív csatolású argon-plazma nem képes biztosítani a gerjesztéshez szükséges energiát [31]. Egyedüli lehetőségként a fluor nem-rezonáns atomvonalának (F I 685.602 nm) használata merülhet fel az ICP-AES technika alkalmazása során. Elsőként Windsor és Denton alkalmazta ezt a vonalat, de gyenge kimutatási határról és szűk lineáris tartományról számoltak be [32]. Ezt követően gázok fluortartalmának meghatározásához alkalmazták ezt a vonalat, a mintabevezetést a
- 17 -
plazmába egy gázbemérő hurok vagy egy gázkromatográf összekapcsolásával oldották meg [33,34]. Mintegy 3000-szer kisebb kimutatási határral rendelkező módszert dolgoztak ki a korábbi módszerhez képest. Ez a vonal mikrohullám indukált plazma – atomemissziós módszer esetében is használható [35,36]. Okamoto és munkatársai egy kevésbé elterjedt módszerrel, volfrám csónakból történő elektrotermikus elpárologtatással juttatták a mintát a plazmába. Az elektrotermikus elpárologtatásnak köszönhetően hatásossá és szelektívvé tehető az elemek plazmába juttatása. A mérést szintén az F I vonalon végezték. Érdekesség, hogy a megfigyelési magasságot úgy állították be, hogy az az indukciós tekercs felső két menete közé esett [31]. Módszerüket továbbfejlesztve induktív csatolású plazma – tömegspektrométert alkalmazva a korábbi ICP-AES-re kidolgozott változatnál jobb teljesítményjellemzőkkel bíró módszert fejlesztettek ki [37].
További módszert dolgoztak ki ICP-MS használatával Bayón és munkatársai, akik a fluoridionokat feleslegben adott alumínium(III)-ionokkal reagáltatták, majd egy rövid ioncserélő oszlopon választották el a szabad alumínium(III)-ionok feleslegét az monofluoro-alumínium(III) ionoktól (AlF2+), ezt követően a 27-es tömegszámú alumíniumot detektálták az ICP-MS készülékkel. A monofluoro-alumínium(III) komplexhez tartozó csúcs alatti területből számítható megfelelő hitelesítés után a minta fluoridion-koncentrációja. Ezzel a módszerrel érték el eddig a legjobb kimutatási határt [38].
Atomabszorpciós készülék használatával több kutatócsoport próbálkozott módszert kidolgozni. Corvillo és munkatársai tengervízben határozták meg a fluoridion- koncentrációt azáltal, hogy a mintát elektromos fűtésű grafitkemencébe injektálták alumínium(III)ionok adagolása mellett, majd az elpárologtatást követően az alumínium- monofluorid gyök elnyelését detektálták 227,45 nm-en, egy Pt üregkatód-lámpa segítségével, amelynek szerencsésen ez az egyik emissziós vonala [39]. Módszerüket oly módon fejlesztették tovább, hogy dinitrogén-monoxid – acetilén lánggal működő atomabszorpciós készüléket alkalmazva a lángban szintén detektálható alumínium- monofluorid gyök elnyelését mérve. A kidolgozott módszert fogkrémek ionos és kovalensen kötött fluortartalmának meghatározására használták [40].
Chirkova és munkatársai indirekt módszerrel határoztak meg fluoridiont, az ólom- cirkonát-titanát szelektív oldásának alkalmazásával. Az ólom-cirkonát-titanátot egy oszlopba töltötték és a rajta átvezetett minta fluoridion tartalma az (1) egyenlet alapján
- 18 -
oldja a töltetet. A kolonna átmosása után meghatározták az oldat ólom-koncentrációját atomabszorpciós módszerrel, és ebből számolták a minta fluoridion-koncentrációját [41].
PbZrO3 · PbTiO3 + 8 H+ + 8 F- = 2 Pb2+ + (ZrOF4)2- + (TiOF4)2- + 4 H2O (1)
Két további indirekt módszert is publikáltak, melyekben optikai emissziós spektrométerrel detektálták a szilícium atomvonalán a mintából szilícium-tetrafluorid formájában felszabadított fluoridot [42,43].
2.6. Az ICP-AES módszer Induktív csatolású plazma [30,44]
Az ICP elektród nélküli kisülés, nagyfrekvenciás generátor tekercsében induktívan gerjesztett gázplazma. A plazmaállapot fenntartásának feltétele leegyszerűsítve: az időegység alatti ionizációk száma nagyobb legyen, mint a rekombinációk száma. Plazmagázként legtöbbször argont használnak, amely viszonylag könnyen ionizálható. Az induktív csatolású plazmát három koaxiálisan összeforrasztott kvarccsőben hozzák létre (1. ábra), amely az indukciós tekercs menetei között helyezkedik el. Az argongáz ezekben a
csövekben áramlik különböző sebességgel. A legbelső kapilláris végű csövön a nedves aeroszolt vezetjük be, a középsőn kis áramlási sebességgel a segédgáz (plazmagáz) áramlik, míg a legkülső csövön át jut a plazmatérbe a cső falát hűtő, nagy áramlási sebességű gáz. A frekvencia megválasztásával, a plazmaégő geometriai felépítésével és a három gáz áramlási sebességének változtatásával elérhető, hogy a plazma toroidális szerkezetű legyen.
Ezt a toroidális szerkezetet az ún. felületi effektus hozza létre, amelynek alapja az a jelenség, hogy a nagyfrekvenciás áram mindig a vezető felületén koncentrálódik. Ha tehát a plazmaégő közepén lévő kapillárison keskeny sugárban argonáram irányul a nedves 1. ábra A plazmaégő szerkezete [44]
- 19 -
aeroszollal együtt pontosan a plazma geometriai közepére, akkor ez alagutat fúr a plazmán át anélkül, hogy a plazma stabilitását zavarná. Így lehetővé válik a minta hatékony bejutása a plazmába. A toroid szerkezet nélkül a mintaáram nagy része elkerülné a plazmát, és a gerjesztés nem lenne kielégítő.
A toroidális plazma csatornájában nagy hőmérséklet (8000-10000 K) és viszonylag hosszú tartózkodási idő (1 ms) döntően megszabja az ionizált gáz energiaátadásának hatékonyságát. A nagyfrekvenciás tekercs feletti zónában a plazma elveszti toroid szerkezetét és lángszerű tér alakul ki. Az optimális megfigyelési magasság 15-20 mm-el a nagyfrekvenciás tekercs felett van. A nagy hőmérsékleten és hosszú tartózkodási időn kívül a plazma kémiai környezetének is jelentős szerepe lehet. Minden olyan sugárforrásban, ahol az oxigénnek vagy az oxigénvegyületeknek nagy a parciális nyomása, az elemek egy része olyan oxidot vagy hidroxilgyök-molekulát képezhet, amelyek nem vagy csak extrém nagy energiával disszociáltathatók tovább. Az ICP-plazma ezzel szemben csak argongázt tartalmaz, oxigén csak az oldószerrel és a mintával juthat be.
Ezért ez a sugárforrás olyan elemek meghatározására is hatékony, amelyeknek oxigénhez való affinitása nagy.
Az optikai rendszer és a detektor
A plazmából kijutó fény a spektrométerbe jut, ahol optikai réseken áthaladva a monokromátorba ér, amely a fény hullámhossz szerinti felbontásáról gondoskodik. Ezt általában optikai ráccsal érik el, egyes spektrométerek prizmát is használnak a fény előfelbontására. Az optikát általában kisnyomású argon gázzal öblítik, de létezik olyan készülék is, amely vákuumot alkalmaz. A monokromátorból a detektorba jut a már monokromatikussá vált fény. Detektorként régebben fotoelektronsokszorozót, manapság félvezető (CID) detektorokat használnak. A CID detektorok megjelenésével megvalósulhatott a szimultán spektrométerek széleskörű elterjedése ugyanis előttük egy szimultán spektrométer csak annyi elemet tudott meghatározni, amennyi fotoelektronsokszorozót tartalmazott a készülék. A CID detektorok a digitális fényképezőgépekben is használt detektorokhoz hasonlítanak, csak ebben az esetben az egyes pixelekre más-más hullámhosszúságú fény érkezik a monokromátorból. A detektor elektromos jelét PC dolgozza fel.
- 20 -
2.7. Atomspektroszkópiai módszerek automatizálása
Az elektronika fejlődésével egyre nagyobb érdeklődés mutatkozott a különböző analitikai módszerek automatizálásának irányába. A legnagyobb jelentősége ennek talán a gáz- és folyadékkromatográfiás készülékek esetében volt, hiszen előbbinél pontosabb mintabevitelt tett lehetővé a kézi injektálásnál, utóbbinál a változtatható injektálási térfogat (részlegesen tölthető mintabemérő hurok) valósulhatott meg, illetve mindkét módszer esetében növelte az analitikus szabadságát az által, hogy a minták automata mintaadagolóba behelyezését követően, nem volt más dolga, mint a mérési eredmények kiértékelése.
Az említett módszereken kívül természetesen az automatizálás igénye az atomspektroszkópiai módszereknél is felmerült. Az automata mintaadagolóval válhatott elterjedtté az elektrotermikus atomabszorpciós spektrometria, mivel a néhány 10 l-nyi minta injektálása kézzel nem megfelelő precizitású. A különféle atomabszorpciós módszerek fejlődésével, igény mutatkozott nem csak automatizált mintaadagoló, hanem komplett pumpákat és kromatográfiás váltószelepet is üzemeltető mintaelőkészítő egységekre is. Ezek teremtették meg a tárgyi feltételeit a „flow-injection” módszereknek, melynek a legnagyobb jelentősége a hidrid-képző elemek (Sn, As, Se) és a higany meghatározásánál van. Az atomabszorpciós készülékbe a hidridet vagy a gőz állapotú higanyt argon gázzal juttatják egy 100-400 °C-ra felfűtött kvarccsőbe, ahol a hidridek atomizálása könnyen lejátszódik, és az atomos állapotú fémgőzben lehetőség nyílik az atomabszorpciós mérésre. Ezeket a mintaelőkészítő egységeket nem csak atomabszorpciós spektrométerhez kapcsolva [45,46], hanem ICP-AES [47] és ICP–MS [48] készülékekkel is elterjedten használják. Több alkalmazást találni az irodalomban a higany meghatározásán és a hidrid-képző módszeren kívül a mérendő komponens dúsítására, a mátrix eltávolítására [49,50] vagy más jellegű mintaelőkészítésre [51] ezeknek az eszközöknek a segítségével.
2.8. A cérium(III)ion fluoridionnal és szulfátionnal alkotott komplexeinek vizsgálata
A lantanoidák fluoro-komplexeinek tanulmányozása kiemelt, mivel a fluoridion szabályozza a természetes hidrotermálfolyadékbeli mobilitásukat [52]. Ezen kívül a
- 21 -
lantanoidák kitűnő indikátorai a geokémiai folyamatoknak. Sikeresen alkalmazták a vulkanikus kőzetek eredetének megállapításához azáltal, hogy meghatározták a nyomelemek megoszlását a kőzetekben [53]. Nagy az érdeklődés a természetben lejátszódó geokémiai körfolyamatok tanulmányozása szempontjából a nyomelemek oldat kémiája iránt is. A speciáció nagy hatással van azokra a kémiai reakciókra, melyek a körfolyamatok mint például az üledékképződés, a torkolati keveredés vagy a talajvíz transzportja során játszódnak le. A nyomelemek egy bizonyos csoportját, a ritkaföldfémek speciációját széleskörűen tanulmányozták és modellezték, így viszonylag jól ismert [54]. A fluoro-komplexek stabilitási állandói ismeretében a természetes közegbeli megjelenési formáik aranyát jósolni lehet [55]. Vitát képez a ritkaföldfémek mobilitása a kőzetek képződése, átalakulása és a hidrotermális változások során, melyről számos tanulmány készült [56].
A lantanoida-ionokat változatos elektromos, mágneses, optikai és nukleáris tulajdonságaik miatt széles körben használják fel. Köszönhetően az ultraibolya, látható és infravörös tartományban található éles f-f (és f-d) abszorpciós és emissziós sávjaiknak elsősorban lumineszcenciát alkalmazó készülékekben, optikai kommunikációhoz és biokémiai kutatásokhoz vizsgálták felhasználhatóságukat [56,57].
A cérium-fluoro komplexek stabilitási állandóit számos módszerrel meghatározták. A legtöbb vizsgálatot a monofluoro-cérium(III) komplex stabilitási állandójának meghatározásához végezték. Az első eredményt Kury és munkatársai publikálták: az alkalmazott módszer a cérium(III)ion és a vas(III)ion fluoridért való versengésén alapszik egy vas(II)/vas(III) koncentrációs cellában [59]. Majd Walker és Choppin is vas(II)/vas(III) elektródot használt kiegészítve radioanalitikai méréseiket [60]. Népszerűek voltak a folyadék-folyadék megoszláson (extrakción) alapuló meghatározások, ahol radionyomjelzők segítségével oldották meg a cérium-koncentráció meghatározását [60-63].
Ezt a módszert alkalmazta Menon és munkatársai, kiegészítve a fluoridion koncentrációjának ionszelektív elektróddal történő potenciometriás meghatározásával [64].
A stabilitási állandók potenciometrikus meghatározásához az elektrokémia fejlődésével változtak az alkalmazott elektródok. Kezdetben membrán elektródot használtak [65,66], majd lantán-fluorid elektródot [64,67-71]. Napjainkban rendkívül népszerű módszer az induktív csatolású plazma – tömegspektrometria (ICP-MS), így ioncserés megoszlással kombinálva a legfrissebb publikációkban alkalmazott módszer [72-74]. Ezzel lehetőség
- 22 -
nyílt a lantanoida fluoro-komplexek stabilitási állandójának egymás jelenlétében történő meghatározásához.
A pH beállításának is fontos szerep jut a stabilitási állandó meghatározásánál, amiben meglehetősen nagy az egyetértés a kutatók között, a cérium(III)ion hidrolízisének visszaszorításáért mindenképpen kis pH-t kell választani. Amennyiben azt szeretnénk elérni, hogy a cérium(III)ionok 99%-a szabad ionként legyen jelen kb. 1,5 alatt kell tartani a pH-t. Ellenkező esetben számolni kell a cérium(III)-hidroxo komplexek jelenlétével.
Némely publikációban többnyire nem állították be az oldatok pH-ját, így azok a cérium(III)ionok hidrolízise miatt gyengén savasak. A savas pH tartományban végzett kísérletek kiértékelésénél pedig tekintettel kell lenni a fluoridionok protonálódására is.
Vitát képez az ionerősség beállítása: mivel az ionerősség beállításához használt vegyület relatív nagy koncentrációban (max. 1 M) van jelen, mégsem léphet reakcióba a fémionnal, így meglehetősen leszűkül a lehetséges vegyületek köre. Annak ellenére, hogy már korábban is ismert volt a cérium(III)-kloro- és nitrátó komplexek létezése, számos kutatócsoport alkalmazott nátrium-kloridot, nátrium-nitrátot, salétromsavat az ionerősség beállítására. Mára ez a bizonytalanság eldőlni látszik, és az utóbbi kutatásokban kizárólag nátrium-perklorátot (esetleg perklórsavat) használnak [63]. Ugyanakkor figyelmet szentelnek a nátrium-klorid jelenlétében mérhető stabilitási állandóknak is, hiszen a tengervíz egyik fő komponense.
A stabilitási állandók meghatározásánál az utóbbi időben az figyelhető meg, hogy a lantanoida fémionok (hasonló tulajdonságai miatt gyakorta kiegészítve az ittriummal) komplexálódását ugyanabban az oldatban vizsgálják, így a kísérleti paraméterek eltérése minimalizálható és az egyes stabilitási állandók összehasonlíthatóvá válnak, megállapítva egyfajta trendet. A lantanoidák kémiai viselkedésük tekintetében nagy mértékben hasonlítanak egymásra, ugyanakkor a lantanoida kontrakciónak nevezett jelenség (az ionrádiusz csökkenése a rendszám növekedtével) miatt bizonyos tulajdonságaik szisztematikusan változnak, így komplexeik stabilitási állandója is. Ezek egyidejű meghatározásához olyan analitikai módszert kellett találni a kutatóknak, amely képes megfelelő precizitással a lantanoidák egymás jelenlétében történő meghatározására, erre pedig egyedülállóan csak az ICP-MS technika alkalmas [72-74].
Külön figyelmet érdemel Sawant és munkatársai 2001-ben publikált munkája, melyben kiemelten kezelik a cérium(III)ion beviteli formáját ugyanis azt is perkloráttá alakították,
- 23 -
így teljesen megszabadulva a nitrátionok jelenlététől. Mivel a cérium(III)-perklorát előállítása közben a perklórsav könnyen oxidálhatja a cérium(III)ionokat cérium(IV)- ionokká, ezért ezeket kinhidronnal redukálták vissza, mivel azok jelenléte szerintük korábbi munkáknál is kísérleti hibához vezetett ugyanis a monofluoro-cérium(IV)- komplex stabilitási állandója öt nagyságrenddel nagyobb a monofluoro-cérium(III) komplexénél, ezen kívül a cérium(IV)ion hidrolízisre és polimerizációra jelentősen hajlamosabb a cérium(III)ionnál [71,75].
Az irodalomban fellelhető stabilitási állandók értelmezését és összehasonlítását megnehezíti az, hogy az eredmények megadása meglehetősen eltér az IUPAC ajánlásától.
Az egyes munkák a cérum(III)ion hidrogén-fluoriddal való reakciójára adják meg a stabilitási állandókat a (2) és (3) egyenlet szerint. Ez annyiban tér el az IUPAC ajánlásától, hogy a szabad fluoridionnal való reakciót kellene megadni, tehát számolni kell a fluoridion protonálódásával. Ez a pH mérésével és a fluorid protonálódási állandójának ismeretében (pKa) a stabilitási állandók átszámolhatók és összehasonlíthatóvá válnak. Az eltérő ionerősségek mellett mért stabilitási állandók összehasonlításához a Debye-Hückel egyenlet alapján a stabilitási állandók zéró ionerősségre extrapolálhatók [76]. Luo és Byrne 2007-ben megjelent publikációjában hasonlították eddig össze a stabilitási állandókat, amelyeket különböző ionerősségek és ionerősség beállító sók mellett mértek. Így a mérési pontokra illesztett görbével az egyenlet paramétereinek segítségével meghatározhatók a stabilitási állandók a közbülső pontokban is [74]. A K2/K1 (lépcsőzetes stabilitási állandók) arányát is gyakorta vizsgálják a kötés erősségének megállapításához. Amíg korábban kiugrónak vélték a lantanoidák közül a cérium K1/K2 arányát (különböző publikációk adatait tekintve a lantanoidáknál ez az arány 0,06 és 0,09 közötti, kivétel a cérium, melyre ez 0,5 [63,72]), addig Luo és Millero bebizonyították, hogy csak kísérleti hibáról volt szó [73].
Ce xHF
CeFx
3x xH3 (2)
][HF]
[Ce
] H [ β CeF
* 3 x
x x - 3 x
x
(3)
Néhány fontosabb publikáció eredményét a 2. táblázatban foglaltam össze, feltüntetve a megadott stabilitási állandókat.
- 24 - 2. táblázat
A cérium(III)-fluoro komplexek stabilitási állandói
Módszer Ionerősség pH log*1 log*2 Hiv.
Redoxi
0,5 (HClO4, Fe(III)/Fe(II)
ClO4) 1,11 1,6 [56]
Elektromigráció 0,1 (NaClO4) - 3,20 [78]
Ioncsere 0,5 (NaClO4) - 3,68 [79]
Potenciometria és
nefelometria nem állandó 5,75 4 [77]
Redoxi 1,0 (NaClO4) - 2,81 [60]
Megoszlás 1,0 (NaClO4) - 2,72 [60]
Ioncsere és folyadék-
folyadék megoszlás 0,5 (NaClO4) - 2,81 [61]
Potenciometria 1 (NaCl, HCl) 3 2,46 4,74 [62]
F--szelektív elektród 1 (NaCl) 3,26 2,71 [67]
Potenciometria 0,5 (NH4NO3) 3,17 3,00 5,01 [64]
F--szelektív elektród 0,5 (NH4NO3) 5,5 2,90 6,57 [68]
Oldószerek közötti
megoszlás 0,68 (NaClO4,
HClO4) 5 2,76 4,60 [63]
Ioncsere, majd a fémion koncentrációjának
meghatározása ICP-MS-sel 0,025 (HNO3) 1,6 3,13 5,95 [72]
F--szelektív elektród 1 (NaClO4) 3,42 2,94 [71]
Ioncsere, majd a fémion koncentrációjának
meghatározása ICP-MS-sel
0,025 (NaClO4) - 3,29 5,48 [73]
Ioncsere, majd a fémion koncentrációjának
meghatározása ICP-MS-sel
0,1 (NaClO4) 4,5 3,2 [74]
A cérium(III)-fluorid csapadékképződési állandójának meghatározását kezdetben együtt végezték a cérium(III)-fluoro komplexek stabilitási állandóinak meghatározásával, majd később ez különvált, részben a vizsgálati módszerek, részben a kísérleti paraméterek különbözősége miatt. A közölt publikációk alapján teljesen nyilvánvaló, hogy cérium(III)- trifluoro komplex oldatban nem létezik, a só csapadékként kiválik [62,68]. Az egyes módszereket és a velük meghatározott stabilitási állandókat a 3. táblázatban foglaltam össze.
- 25 - 3. táblázat
A cérium(III)-fluorid oldhatósági szorzatai
Módszer pL Hiv.
Potenciometria 17,85 [80]
Konduktometria 14,96 [81]
Radiometria 15,09 [27]
Konduktometria 19,2 [82]
Potenciometria 17,1 [66]
Radiometria 19,1 [83]
Radiometria 16,66 [64]
Potenciometria 16,06 [64]
Konduktometria 16,07 [64]
Konduktometria 16,1 [68]
Potenciometria 16,1 [68]
Radiometria 16,7 [68]
A cérium(III)ion szulfátionnal alkotott komplexeiről korántsem szól annyi tanulmány, mint a cérium(III)-fluoro komplexekről. Ez elsősorban kisebb környezetkémiai szerepüknek köszönhető. Carvalho és Choppin oldószerextrakciós és potenciometrikus módszerrel határozták meg elsőként a stabilitási állandóját néhány lantanoida(III)-szulfátó komplexnek [84]. Ezt követően számos különféle módszert alkalmaztak eddig a cérium(III)-szulfátó komplexek stabilitási állandójának meghatározására: elektroforézis [85], infravörös spektroszkópia [86], UV-spektrofotometria [87], ioncsere reakció [61,88-90], dilatometria [91], oldószerextrakció [61,92]. A közölt eredményeket tekintve 1,24 és 2,47 között változik a monoszulfátó-cérium(III) komplex stabilitási állandójának logaritmusa, viszont ezek az eredmények így nem hasonlíthatók össze a különböző ionerősségek mellett végzett mérések miatt (általában az ionerősség beállítására nátrium- perklorátot alkalmaztak). Több kutatócsoport is úgy találta, hogy a cérium(III)ionhoz nem csak egy, hanem kettő szulfát is koordinálódhat. A legfrissebb közleményben [93] ‒ mely 2004-ben jelent meg ‒ több analitikai módszert is alkalmaztak a szerzők az ittrium- és a ritkaföldfémionok komplexálódásának nyomonkövetésére, amely a bárium-szulfát
- 26 -
szelektív oldódásán alapul. A kísérletek során vizsgálták az oldat pH-ját, az oldatok szulfát-koncentrációját ionkromatográfiával, illetve az ittrium-, a ritkaföldfém- és a bárium-ionok koncentrációját ICP-MS módszerrel. A számos eredmény ellenére továbbra is vitát képez a cérium(III)-szulfátó komplexek belső vagy külső-szférás jellege.
2.9. A cérium(III)ion fluoro-komplexeinek fotofizikai vizsgálata Az f-mező vegyületeinek elektrongerjesztési vizsgálatához és a sajátságok megértéséhez a cérium(III)ion ‒ mivel egyetlen 4f1 vegyértékelektronnal rendelkezik ‒ egyszerű modellnek számít, ezért széleskörűen vizsgálták. Kezdetben a szikraszínképek alapján még 5d1 elektronkonfigurációt feltételeztek, majd alaposabb röntgenvizsgálatokkal megállapították, hogy a 4f alhéjon elhelyezkedő elektronhoz tartozó 2F term kb. 50 kK (1 kiloKaiser=1000 cm-1) energiával alacsonyabb, mint az 5d1 konfigurációból származó
2D, így az előbbi az alapállapotú ion alaptermje. Ez a spin-pálya csatolás következtében
~2 kK körüli felhasadást szenved, így a tényleges alapterm a 2F5/2, mivel Hund 3. szabálya értelmében kisebb energiája van, mint a 2F7/2 termnek. Mivel ez az energiagát nagyobb, mint a normál körülményekhez tartozó hőmozgás energiája, ezért az összes ion az előbbi állapotban található. Az elektronátmenetek leírását kiegészítve további külső pályákból származó termre is szükség volt: a 2D-eken kívül a 2S és a 2P termekre. A gerjesztési energia leadásának időbeli követése alapján megállapították, hogy a lecsengés egyszerű elsőrendű kinetikát mutat, tehát egyexponenciális, melynek élettartama ~10-4 s körüli (később, az időfelbontásos technika fejlődésével sokkal kisebb értékeket mértek) [94].
Az elektrongerjesztési spektrum mélyebb értelmezésében a kristálytér-felhasadás elmélet segített: a 200-400 nm tartománybeli több elnyelési sáv megjelenésének oka a 2D term ~10 kK nagyságú felhasadása, melyet egyrészt a kialakuló szerkezet szimmetriája határoz meg: kocka és tetraéderes (Td) szimmetria esetén 2D 2E + 2T, oktaéder (Oh) esetén 2T + 2E (fordított az energiasorrend), míg trigonális prizma (D3h) elrendeződésnél
2A1’ + 2E’ + 2E”. Másrészt a felhasadás mértékére ‒ így az elektronátmenetek energiájára ‒ a ligandum / anion típusa is hat: a szabad Ce3+ ionban a 4f – 5d alhéjak energiakülönbsége 51 kK, a CeF3-ban 48 kK, a Ce2O3-ban már csak 35 kK; mivel a kötés kovalens jellegének erősödésével az elektronok közötti taszítási paraméter csökken (nefelauxetikus hatás). A cérium-vegyületekre sokszor jellemző trigonális prizma elrendeződéseknél a gerjesztési energia sugárzásos folyamatban, vagyis lumineszcencia során történő leadása esetén azt
- 27 -
tapasztalták, hogy általában ez csak a legalacsonyabb energiájú, 2A1 altermről valósulhat meg még az ultraibolya tartományban. A Blasse és Bril szerzői a látható fény tartományába eső, a hőmérséklettől és a koncentrációtól (belső elnyelődés révén) függő kisugárzást is megfigyeltek, amely nem mindig jelentkezik. Magyarázatként azzal szolgáltak, hogy az elnyelési és kisugárzási energia közötti nagy különbséget (ún. Stokes-eltolódást) lágy ionok kötődése okozhatja, vagy inkább a gerjesztett, 5d alhéjból származó altermek közötti elektronátmenetekhez tartozhatnak – mely jelenség egyébként alacsony hőmérsékleten ismert [95]. Ez a magyarázat szerintem mégsem helyes – és ezt alátámasztja az is, hogy későbbi közleményeikben már nem is említik ezt a fajta lumineszcenciát, inkább az történhetett, hogy a vizsgálat során alkalmazott gerjesztő fénynek vagy a nagyon hatékony és intenzív ultraibolya emissziónak a fotoelektronsokszorozóban megjelenő alharmonikusát detektálták.
A ligandumok gerjesztett állapotokra kifejtett hatásának széleskörű vizsgálata arra az eredményre vezetett, hogy az 5d alhéjhoz tartozó pályákat a kristálytér jobban befolyásolja, mint a 4f alhéjhoz tartozókat, melyeket az 5d és a 6s alhéj jelentősen le is árnyékol. A legkisebb energiájú gerjesztés (trigonális prizma szimmetriában a 2F5/2 2A1
elektronátmenet) ~33 kK körüli energiája az alkalmazott perklorát-, klorid- és szulfát- ionok esetén szinte független a ligandumtól. És a kisugárzás (mivel erről az állapotról következik be – bár ők nem teljesen ezzel magyarázták) tulajdonságai függetlenek a ligandumoktól kvantumhatásfok és élettartam tekintetében is. Ezt többféle módon értelmezték, melyek közül azt tartották a legvalószínűbbnek, hogy a vizes közegben képződő okta- és nonaakva-cérium(III) komplexek közötti egyensúlyra szuperponálódnak az anionok külső- és belsőszférás komplexálódásai, melyek a hőmérséklettől függenek. Azt gyanították, hogy a legkisebb energiájú elnyelési sáv hiányzik a [Ce(H2O)9]3+ (nona, tehát 9-es koordinációs számú, mindhárom négyzetlapján centrált trigonális prizma=TPRS-9) komplexből, mely viszont a koncentráció és a hőmérséklet csökkenésével stabilizálódik, tehát az lesz jelen döntő mennyiségben. Az említett sáv és ezáltal a kisugárzás is a [Ce(H2O)8]3+ (okta, azaz a 8-as koordinációs számú kocka=CU-8 vagy négyzetes antiprizma=SAPR-8, melyek bármelyikében a szimmetria eltér az előzőtől) formához tartozna, hiába csekély az egyensúlyi részaránya: 1-2,5 %. Ez úgy volna lehetséges, hogy a többi komplexforma a mért kisugárzási időnél gyorsabban és egységnyi hatásfokkal alakulna át [Ce(H2O)8]3+ komplexszé [96]. Ez a feltételezés a későbbiekben még inkább megkérdőjelezhetővé vált, hiszen víz ligandumok távollétében is hasonló kisugárzások mérhetőek.
- 28 -
Az abszorpciós sávok – főleg a legkisebb energiával rendelkező – jelentősen függenek az oldószertől, illetve a koncentráció-viszonyoktól is [97], azaz a gerjesztési színképet jelentősen befolyásolja a Ce3+ és a ligandum (pl. F-) külső atompályáinak egymáshoz viszonyított helyzete [98]. A halogenidion lágyságával nő a Ln-X kötés kovalens jellege, ezzel együtt az erre érzékeny sávok intenzitása és hullámhossza: a fémion 4f5d elektronátmenete keveredik egy Ce3+ 4f X- nd típusú, fémionról ligandumra irányuló töltésátvitellel, melynek következtében a Cl-Br-I sorban az emisszió erősen a vörösbe tolódik (sorrendben az emissziós maximum 362, 390 és 514 nm) [99].
A könnyebb lantanoida(III)-ionok kristályvizes egykristályaikban 9-es koordinációs számú halogeno-hidas dimereket [(H2O)7LnXXLn(H2O)7]4+ képeznek, a nehezebbek pedig 8-as koordinációs számú monomereket [LnX2(H2O)6]+, melyek különbségének egyértelmű spektroszkópiai jelei vannak [100].
A kristálytér-elmélet szerint a koordinatív kötést tisztán elektronikus / ionos kölcsönhatásként próbálták leírni, ám hamar bebizonyosodott a cérium-vegyületek elektongerjesztési sajátságaik tervezhetőségének vizsgálatánál is, hogy nem lehet elhanyagolni a kötések kovalens jellegét, vagyis a társuló konfigurációkeveredéseket, ezért a ligandumtér- vagy a korrelált kristálytér-elmélettel kell számolni. Ez alapján megállapították, hogy az 5d alhéjból származó termek energia-középértéke (tehát a felhasadásmentes alhéj energiája) változatlan, a felhasadás mértéke változik csak a ligandum minőségével, valamint a kötéstávolsággal (pontosabban annak ötödik hatványával). Ezenkívül az elektrongerjesztési tulajdonságok megfelelő pontosságú jóslásán alapuló, hangolható lézertervezéshez még a Stokes-eltolódások pontos ismerete is szükséges [101].
A cérium-vegyületek fénykisugárzási sajátságának egyik fontos alkalmazási területe a szcintilláció, melyhez a nagyenergiájú sugárzás hatására bekövetkező nagy kvantumhatásfokú és gyors lumineszcenciára van szükség válaszjelként. A teljes fénykibocsátás jelentősen függ a felülettől is. A kevésbé higroszkópos cérium(III)-fluorid elterjedten használatos szcintillátor, melynek válaszjele kétkomponensű: a gyorsnak az ideje 5 ns, hullámhosszának maximuma 310 nm, míg a lassabbnak az ideje 30 ns, hullámhossza pedig 340 nm; továbbá a kisugárzási energia szobahőmérsékleten 1:2 arányban oszlik meg a kettő között, mely arányt a hőmérséklet változtatása számottevően befolyásol [101].
A kétexponenciális lecsengést „belső” és „külső” (intrinsic and extrinsic) kisugárzásként próbálták mások értelmezni utalva arra, hogy az egyik komponens a rács perturbált,
- 29 -
„külső” helyein található cériumionokból származik, melyekre rácshibák vagy szennyezők hatnak, így két fémion az energiaátadás hatótávolságán belül közel kerülhet egymáshoz kiváltva a gyorsabb lecsengést [103,104]. Egy másik megközelítésben a rács szabályos helyein lévő Ce3+ ionokhoz tartozónak tulajdonítják a gyorsabb és kisebb hullámhosszú, a perturbált helyeken lévőkhöz a lassabb és nagyobb hullámhosszú emissziót, mely utóbbiért egyértelműen a rácshibákat teszik felelőssé: egyik anionnak a rácshibába, lyukba irányuló, Stokes-eltolódás vezérelt mozgása eredményezheti a kristálytér torzulásával együtt ezt a fotofizikai sajátságot [105]. Mások szerint ionizáló sugárzás kell a gyorsabb komponens megjelenéséhez, mert optikai gerjesztés esetén csak a lassabb detektálható [106].
Ha a cériumionokat csak adalékként használják pl. más lantanoida-trihalogenidekben, akkor a szcintilláció még összetettebb kinetikát is mutathat: három exponenciális és több nem-exponenciális komponens {(1+a×t)-b} is megjelenik LaCl3, LuCl3 és LuBr3 esetén is ön-elnyelő exciton kisugárzás következtében [106,107].
2.10. A cérium(III)-fluorid jelentősége
A cérium(III)-fluoridot eredményesen használják katalizátorként [109], erősítőkben [109], hangolható szilárd-test lézerekben [101,111], félvezetőként, érzékenyítőkben, nukleáris fűtőelemekben, üveg csiszoláshoz és az orvosi diagnosztikában [57]. A cérium(III)-fluorid hatékony szilárd kenőanyag, mivel réteges szerkezettel bír: jó kopás-, és súrlódáscsökkentő, kiemelkedő a nyomásállósága és kitűnő tribológiai tulajdonságokkal rendelkezik, még nagy hőmérsékleten is megfelelő mechanikai szilárdsága van [113-118].
Fontos előnyös tulajdonsága, hogy kevésbé higroszkópos, mint például a cérium(III)-klorid, így felhasználása is kevésbé körülményes [107].
A legfontosabb felhasználási területe a cérium(III)ionnal adalékolt vagy cérium(III)ion alapú szcintillátorok, mivel gyors és intenzív fluoreszcenciával nagy besugárzási ellenállással, kiemelkedő energia felbontással, nagy sűrűséggel rendelkeznek, viszonylag alacsony áruk van és nincs utóvilágítási tulajdonságuk [101,103,106,119-133].
Ezen kívül használják nagyenergiájú elektromágneses kalorimetriához, radiotomográfiához és a nukleáris folyamatok kutatásához [129].
- 30 -
2.11. Cérium(III)-fluorid nanorészecskék előállítása és tulajdonságaik
Az utóbbi tíz évben részletesen vizsgálták a cérium(III)-fluorid alapú nanorészecskéket és bevonatokat, mivel az előző fejezetben bemutatott sajátságokat a részecskeméret és a felületi tulajdonságok határozzák meg, ezek viszont függenek az alkalmazott előállítási módszertől. A szakirodalomban számos előállítási módszer ismeretes: fordított micellás vagy mikroemulziós módszer [118,134,135], molekulasugaras epitaxia [136], poliol módszer [137,138], fém-organikus kémiai gőzfázisú leválasztás (MOCVD) [139], hidrotermikus [140] vagy extrakciós módszer [141]. Ezeknek az eljárásoknak a többsége munka- és időigényes, és az előállítást követő kalcinálás is ajánlott. A legegyszerűbb módszer a vizes közegben történő csapadékképzés, de a folyamathoz gyakran szükséges valamilyen kezelés, mint pl. a Zhu és munkatársai által publikált gyenge ultrahanggal segített módszer [142]. Jól ismert tény, hogy a jelenlevő anionok minősége és koncentrációja befolyásolja a keletkező csapadék tulajdonságait (pl. karbamid hatása a lantanoida kolloidokra) [109]. A csapadékképződést – a nanorészecskék alakját és méretét – egyaránt befolyásolja az előállítás módszere és a cérium(III)ionok kezdeti koncentrációja [101]. 1,8 nm átmérőjű nanorészecskéket állítottak elő a fordított micellás módszerrel [135], míg 5 nm méretűeket a poliol módszerrel [138]. Ha a csapadékképzők vagy a segédanyagok (pl.: más anionok vagy a mikroemulzióban a víz) koncentrációja kicsi, a nanorészecskék általában gömb vagy henger alakúak [117,118,143,144], de többszögű alakzatok is megjelenhetnek nagyobb koncentrációknál [118].
2.12. Nanorészecskék vizsgálati módszerei
A nanorészecskék vizsgálatára általában az alábbi módszereket használják:
- részecskeméret-eloszlás meghatározása, - zéta-potenciál mérés,
- röntgendiffraktometria, - elektronmikroszkópia,
- rezgési spektroszkópia (infravörös- és Raman-spektroszkópia), - termikus analízis,
- UV-látható spektrofotometria és spektrofluorimetria.