A fehérjekutatás
modern módszertana
A fehérjekutatás modern módszertana
Szerkesztette: Ludány Andrea
Medicina Könyvkiadó Zrt ● Budapest, 2011
© Dr. Ludány Andrea, 2011
© Szerzők, 2011
TÁMOP-4.1.2-08/1/A-2009-0054
© Prof. Dr. Ludány Andrea, 2011
Szerzők:
Prof. Dr. Berki Tímea
Prof. Dr. Kellermayer Miklós Prof. Dr. Kilár Ferenc
Dr. Kiss István
Prof. Dr. Komoly Sámuel Prof. Dr. Kovács L. Gábor Dr. Kőszegi Tamás Dr. Liszt Ferenc
Prof. Dr. Ludány Andrea Dr. Magyarlaki Tamás † Dr. Márk László Dr. Mezősi Emese Dr. Nagy Tamás
Dr. Tőkés-Füzesi Margit Vassné Lakatos Ágnes Prof. Dr. Wittmann István
Lektorálta:
Dr. Janáky Tamás egyetemi docens Szegedi Egyetem, Orvosi Kémia Intézet
Dr. Szabó Antal egyetemi tanár SE I.sz.Gyermekklinika
Medicina
A kiadásért felel a Medicina Könyvkiadó Zrt. igazgatója
Felelős szerkesztő: Benjámin Katalin Műszaki szerkesztő: Dóczi Imre Az ábrákat rajzolta: Olgyai Géza
Ábrák száma: 221 Azonossági szám: 3591 Terjedelem: 49,5 (A/5) ív
Prof. Dr. Berki Tímea
PhD, Med. Habil.
egyetemi tanár
PTE KK Immunológiai és Biotechnológiai Intézet
Prof. Dr. Kellermayer Miklós
DSc egyetemi tanár
PTE KK. Laboratóriumi Medicina Intézet
Prof. Dr. Kilár FerencDSc egyetemi tanár
PTE ÁOK Bioanalitikai Intézet
Dr. Kiss IstvánPhD egyetemi docens
PTE ÁOK Népegészségtani Intézet
Prof. Dr. Komoly SámuelDSc egyetemi tanár
PTE KK Neurológiai Klinika
Prof. Dr. Kovács L. GáborMTA levelező tag egyetemi tanár
PTE KK. Laboratóriumi Medicina Intézet
Dr. Kőszegi TamásPhD, Med. Habil.
egyetemi docens
PTE KK. Laboratóriumi Medicina Intézet
Dr. Liszt FerencPhD egyetemi docens
PTE KK Laboratóriumi Medicina Intézet
Prof. Dr. Ludány Andrea
PhD, Med. Habil.
egyetemi tanár
PTE KK. Laboratóriumi Medicina Intézet
Dr. Magyarlaki Tamás †PhD, Med. Habil.
egyetemi docens
PTE KK. Laboratóriumi Medicina Intézet
Dr. Márk LászlóPhD, Dr. Habil.
egyetemi docens
PTE ÁOK Biokémiai és Orvosi Kémiai Intézet
Dr. Mezősi Emese
PhD, Med. Habil.
egyetemi docens
I. sz. Belgyógyászati Klinika
Dr. Nagy TamásPhD egyetemi adjunktus
PTE KK. Laboratóriumi Medicina Intézet
Dr. Tőkés-Füzesi Margitegyetemi tanársegéd
PTE KK Laboratóriumi Medicina Intézet
Vassné Lakatos ÁgnesPhD egyetemi docens
PTE KK Laboratóriumi Medicina Intézet
Prof. Dr. Wittmann IstvánPhD Med. Habil.
egyetemi tanár
PTE KK II.sz. Belgyógyászati Klinika és Nephrológiai Centrum
A könyv szerzői
A fehérjekutatás modern módszerei, proteomika a klinikai kutatásban
A többszerzős szerkesztett tankönyvet a Medi- cina Könyvkiadó adja ki elektronikus formában.
2012 első negyedévétől lesz elérhető a www.tan- konyvtar.hu honlapon. A szerzők valamennyien a Pécsi Tudományegyetem ismert és elismert oktatói, akik az adott területeken sikeres klinikai laboratóriumi kutatómunkát végeznek.
A könyv a klinikai laboratóriumi kutatásban központi szerepet játszó fehérjevizsgálatok je- lenleg használatos módszertanát tárja a hallga- tók elé. Anyaga feltételez alapvető és megfelelő biokémiai/biológiai előképzettséget.
A könyv 1–10. fejezete a fehérjevizsgálatok módszertanát elsősorban elméleti megközelítés- ben ismerteti gazdag ábraanyaggal. Fejezetről fejezetre kitér a vizsgálati minták előkészítésére, az alapvető elválasztási eljárásokra, funkcionális aspektusokra, műszeres adaptációkra, a fehérjék
azonosítási lehetőségeire, valamint a mérési ada- tok értékelésére.
Az utolsó, 11. fejezet 19 alfejezetben a koráb- ban bemutatott módszertanok közvetlen klinikai laboratóriumi alkalmazására és diagnosztikus/
terápiás hasznosulására nyújt példákat. Ezzel különböző kutatási irányokra tereli az olvasó figyelmét a klinikai patológia területén. Így pl.
a véralvadástól a tumormarkerekig sor kerülhet különböző fehérje vizsgálatokra a legújabb eljá- rások szerint.
A tankönyv anyaga – a szerzők véleménye szerint – minden bizonnyal nem csak a klinikai laboratóriumi kutatók mesterképzéséhez, hanem a terület iránt érdeklődő szakemberek számára is hasznos lehet.
Pécs, 2011. november
Ludány Andrea szerkesztő
Előszó
Rövidítések . . . 17
1. Bevezetés (Kovács L. Gábor) . . . 27
A fehérje mint az élet princípiuma . . . 27
A fehérjék szerkezete, kémiai tulajdonságai . . . 27
Fehérjék az élő sejtben . . . 28
A fehérjék kölcsönhatásai . . . 32
Fehérjék mint enzimek (katalízis) . . . 33
Fehérjék szerepe a struktúraalkotásban . . . 34
Fehérjék szerepe a transzportfolyamatokban . . . 35
Sejtek és fehérjék . . . 35
A sejtek anabolizmusa és katabolizmusa . . . 35
Az emberi szervezet és a fehérjék . . . 36
A fehérjekutatás forradalma: a proteomika . . . 37
Összefoglalás . . . 37
2. A fehérjevizsgálatok általános és alapvető módszerei - a minták előkészítése . . . 39
Különféle minták előkészítése (Ludány Andrea) . . . 39
Sejtes minták előkészítése . . . 40
A sejtek feltárása . . . 40
Interferáló anyagok inaktiválása vagy eltávolítása . . . 40
A fehérjék szolubilizálása (oldatba vitele) . . . 41
A minták tárolása . . . 42
A minták előfrakcionálása az analízisekhez . . . 42
Eljárások (protokollok) . . . 45
Sejt- és szöveti minták extrakciója és szolubilizációja . . . 45
Az interferáló vegyületek eltávolítása a mintákból . . . 47
A minták előfrakcionálása . . . 48
Fehérjemeghatározások . . . 48
Irodalom . . . 50
Sejtes minták vizsgálómódszerei (Kőszegi Tamás) . . . 51
Intracelluláris fehérjék kimutatása . . . 51
Módszertani megközelítések . . . 52
Egyedi fehérjék kimutatása morfológiai módszerekkel . . . 52
Egyedi fehérjék kimutatása egyéb módszerekkel . . . 53
Irodalom . . . 54
Tartalom
3. Fehérjék vizsgálatának bioanalitikai módszerei (Kilár Ferenc) . . . 57
Fehérjék extrakciója . . . 57
Fehérjék kromatográfiája . . . 57
Fehérjék frakcionálása ultracentrifugával . . . 58
Fehérjék vizsgálata elektroforézissel . . . 59
Fehérjék kapilláris-elektroforetikus elemzése. Chip-elektroforézis . . . 59
Fehérjék azonosítása és meghatározása a proteomikában . . . 65
Fehérjék bioinformatikája . . . 66
Irodalom . . . 70
4. Az analitikai kémia módszerei a fehérjekutatásban - Fehérjeelválasztási és fehérjedetektálási technikák . . . 71
(Ludány Andrea, Kőszegi Tamás)
Elektroforézis mint elválasztási technika . . . 71
A klinikai kutatásban használatos módszerek áttekintő ismertetése . . . 71
Gélelektroforetikus technikák - PAGE . . . 71
Preparatív és analitikai PAGE-eljárások . . . 72
Homogén és gradiens gélek . . . 72
Natív és denaturáló PAGE-rendszerek . . . 73
Izoelektromos fokuszálások poliakrilamid- (PAG) és agarózgélben . . . 73
Kétdimenziós elválasztások kombinációi . . . 74
Fehérjedetektálási technikák a klinikai kutatómunkában . . . 74
Izotópos jelölés . . . 75
Festékkötéses jelölés . . . 75
Ezüstözés . . . 75
Fluoreszcens festés . . . 75
Immunreakción alapuló jelölés . . . 75
Protokollok - A klinikai kutatásban általunk adaptált és alkalmazott elválasztási és fehérjejelölési eljárások . . . 76
Elválasztási technikák . . . 76
Nem denaturáló és denaturáló PAGE gélrudakban és lapgéleken . . . 76
Nem denaturáló alkalikus gélelektroforézis (Ornstein és Davis szerint) . . . 76
Denaturáló SDS-gélelektroforézis (Laemmli szerint) . . . 77
Kétdimenziós PAGE denaturáló rendszerben . . . 79
Izoelektromos fokuszálás gélcsövekben . . . 80
Második dimenzió; SDS-elektroforézis homogén vagy exponenciális gradiens poliakrilamidgélben . . . 81
Izoelektromos fokuszálás lapgélen - denaturáló rendszerben (az O’Farrell-technika első dimenziójának megfelelő rendszer) . . . 84
Detektálási technikák . . . 84
Gélelőkészítés autoradiográfiához . . . 84
Fluorográfiás detektálás (Bonner és Laskey szerint) . . . 84
Ezüstözési eljárások . . . 85
Fehérjék direkt ezüstözése egydimenziós SDS lapgélen (Giulian, G. G.) . . . 85
Kombinált (gyors) ezüstözési eljárás leszárított festetlen, ill. festett „nedves”
géllemezeken (Willoughby és Lambert) . . . 85
Ezüstözéses fehérjedetektálás ultravékony PAGE-lemezeken (Sammons) . . . 86
A minták fehérjedúsítása és ezüstdetektálása (Marshall szerint) . . . 87
Fehérjék detektálása Marshall szerint, módosított ultraszenzitív ezüstözési eljárással . . . 87
MS-kompatibilis fehérjedetektálások poliakrilamidgélen . . . 89
MS-analízishez ajánlott CBB-festés (Wang) . . . 89
MS-kompatibilis ezüstfestés gélben (Gromova) . . . 89
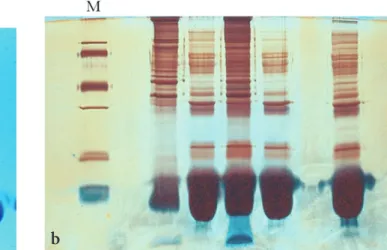
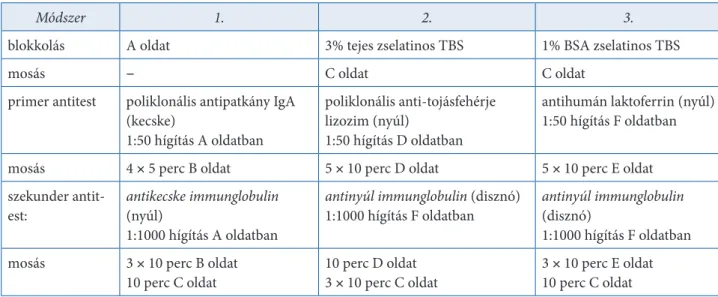
Immunoblotting technikák fehérjék azonosítására . . . 90
Mini-Trans-Blot készülék használata („nedves” eljárás) . . . 90
Immunoblotting technika a fehérjék azonosítására (semi-dry blotting) . . . 93
Az immunreakció „előhívása” . . . 94
Poliakrilamidgél-lemez szárítása zselatinnal (Popescu szerint) . . . 98
Irodalom . . . 98
5. Fehérjék vizsgálata biológiai funkcióik alapján (Kellermayer Miklós) . . . 101
Immunglobulinok, antitestek és a komplementrendszer . . . 104
Történeti áttekintés . . . 104
Az immunglobulonok, az antitestek és a komplementek szerkezete, molekuláris sajátosságai . . . 105
Az immunglobulinok, az antitestek és a komplementrendszer funkciói . . . 106
Az immunglobulinok és az antitestek vizsgálata . . . 107
Motorfehérjék, kontraktilis fehérjék, intracelluláris vázfehérjék (citoszkeleton) . . . 109
Történeti áttekintés . . . 109
A kontraktilis fehérjék, a motorfehérjék és a citoszkeletonfehérjék szerkezete, molekuláris sajátosságai . . . 110
A kontraktilis fehérjék, a motorfehérjék és a citoszkeletonfehérjék funkciói . . . 112
A kontraktilis fehérjék, a motorfehérjék és a citoszkeletonfehérjék funkcióira irányuló vizsgálatok . . . 112
Enzimek, biokatalizátorok . . . 112
Történeti áttekintés . . . 113
Az enzimek, biokatalizátorok molekuláris sajátosságai . . . 113
Az enzimek funkciói . . . 114
Az enzimek, biokatalizátorok funcióira irányuló vizsgálatok . . . 114
Hormonok . . . 115
Történeti áttekintés . . . 115
A hormonok molekuláris sajátosságai . . . 115
A hormonok funkciói . . . 116
A hormonok vizsgálata funkcióik alapján . . . 116
A sejtnövekedést befolyásoló fehérjék, peptidek, a sejtnövekedési faktorok, a biológiai válaszmódosítók („biological response modifiers”) . . . 116
Történeti áttekintés . . . 116
A sejtnövekedési faktorok, a „biológiai válaszmódosítók” molekuláris sajátosságai . . . 116
A sejtnövekedési faktorok, a “biológiai válaszmódosítók” funkciói . . . 117
A sejtnövekedési faktorok, a „biológiai válaszmódosítók” vizsgálata funkcióik
alapján . . . 117
Extracelluláris szerkezeti elemek . . . 117
Történeti áttekintés . . . 118
Az extracelluláris, főként szerkezeti elemként funkcionáló fehérjék molekuláris
sajátosságai . . . 118
Az extracelluláris szerkezeti fehérjék funkciói . . . 119
Az extracelluláris szerkezeti fehérjék vizsgálata . . . 119
Raktárak . . . 120
Történeti áttekintés . . . 120
A raktárfehérjék molekuláris sajátosságai . . . 120
A raktárfehérjék funkciói . . . 120
A fehérjeraktárak funkcióira irányuló vizsgálatok . . . 121
Transzportőrök (szállítófehérjék) . . . 121
Történeti áttekintés . . . 122
A transzportőrök, a szállítófehérjék molekuláris sajátosságai . . . 122
A transzporterek, a szállítófehérjék funkciói . . . 122
A transzportfehérjék azonosítása funkcióik alapján . . . 122
Ligandumok . . . 122
Esszenciális táplálékok . . . 123
Irodalom . . . 123
6. Immunkémiai eljárások a fehérjék azonosításában - Specifikus fehérjekimutatások oldatban és szilárd fázisú rendszerekben (Berki Tímea) . . . 125
Immunológiai alapok . . . 126
Immunológiai fogalmak . . . 126
Antitest-előállítási módszerek . . . 132
Ellenanyagok, antigének jelölése . . . 136
Konjugálási módszerek . . . 139
Immunológiai alapú laboratóriumi módszerek csoportosítása . . . 139
Antigén-antitest reakciókon alapuló módszerek . . . 139
Precipitáción alapuló eljárások . . . 140
Agglutináción alapuló módszerek . . . 141
Immunoassay . . . 142
Immunoassay-típusok csoportosítása . . . 142
Módszerek . . . 145
Az immunoassay-t befolyásoló faktorok . . . 156
Az immunoassay-k fejlesztési irányai . . . 158
Irodalom . . . 159
7. Műszeres analitikai lehetőségek a klinikai laboratóriumi fehérjevizsgálatokban . . . 161
Automatizáció a fehérjeanalitikában (Kőszegi Tamás) . . . 161
Általános szempontok . . . 161
Immunprecipitáción alapuló módszerek . . . 161
Immunturbidimetriás módszerek . . . 162
A turbidimetriás jel mérése . . . 163
Egyéb megfontolások . . . 163
Nefelometria . . . 164
Immunkémiai analitikai technikák (immunoassay-k) . . . 164
Történeti áttekintés . . . 164
Az immunoassay-kben leggyakrabban alkalmazott jelölések . . . 165
A mért jel detektálásának módjai . . . 167
Immunoassay-k típusai a közeg kialakítása szerint . . . 168
Immunoassay-k típusai a reakcióelv szerint . . . 169
Néhány példa a heterogén eljárások technikai megoldásaira . . . 169
Példa homogén eljárás technikai megoldására . . . 170
Az immunoassay-k kalibrációjának módjai . . . 171
Analitikai interferenciák . . . 172
Interferenciák kiküszöbölésének lehetőségei . . . 173
Különböző immunkémiai módszerek érzékenységének összehasonlítása . . . 174
Irodalom . . . 174
Műszeres analitikai lehetőségek - Tömegspektrometria (Márk László) . . . 175
A tömegspektrométer elvi felépítése . . . 175
A vákuumrendszer . . . 175
Mintabevitel . . . 176
Ionforrások . . . 176
Analizátor . . . 179
Detektor . . . 181
Fragmentálás és tandem tömegspektrometria . . . 182
A tömegspektrum . . . 183
A tömegspektrometria főbb alkalmazási területei . . . 184
Irodalom . . . 185
8. A vizsgálati eredmények kifejezésmódjai - Dimenziók, vonatkoztatások (Liszt Ferenc) . . . 187
Mértékegységrendszerek . . . 187
Az analitikai referenciarendszer és elemei . . . 188
A fehérjemeghatározások standardizálása . . . 190
Normálérték és referenciaérték . . . 193
Irodalom . . . 194
9. A vizsgálatok kontrollja, ellenőrzése, pontossága, helyessége (Lakatos Ágnes) . . . 197
Irodalom . . . 201
10. Sejtkultúrák, sejttenyésztés a klinikai kutatásban (Nagy Tamás) . . . 203
Előzmények . . . 203
Sejttenyésztés . . . 203
Sejttípusok . . . 203
Tenyésztőedények, flaskák . . . 206
Inkubátor . . . 206
Médiumok . . . 207
A tenyészetek kezelése . . . 209
A tenyészet kontaminációja . . . 211
Fagyasztás, fagyasztásból való felolvasztás . . . 212
A tenyészet sejtjeinek osztódása, sejtszámváltozások . . . 213
Detektálás - A sejtkultúra állapotának ellenőrzése, az állapot változtatása . . . 215
Állatkísérleti modellek . . . 216
Irodalom . . . 219
11. A fehérjekutatás modern módszereinek alkalmazása a klinikai patológiában - Az új módszertanok klinikai hasznosulása az orvosi kutatólaboratóriumban . . . 221
A vérszérum és a vérplazma fehérjevizsgálatai (Tőkés-Füzesi Margit) . . . 221
A plazmafehérjék általános áttekintése . . . 221
Plazmafehérje-csoportok és vizsgálatuk . . . 222
Összfehérje . . . 222
Albumin . . . 222
A plazmafehérjék elektroforézise . . . 222
A különböző frakciókban vándorló jelentősebb fehérjék rendellenességei betegségekben . . . 224
Az albuminfrakcióban található fehérje . . . 224
Az α
1-frakcióban található fehérjék . . . 224
Az α
2-frakcióban található fehérjék . . . 225
A β-frakcióban található fehérjék . . . 225
A γ-frakcióban található fehérjék - Az immunglobulinok . . . 226
Irodalom . . . 233
Kis molekulatömegű fehérjék, peptidek, peptidhormonok kimutatása . . . 234
(Kőszegi Tamás)
A kis molekulatömegű fehérjék jellemzői . . . 234
A kis molekulatömegű fehérjék kimutatási lehetőségei . . . 235
Módszertani megközelítés . . . 235
Előzetes frakcionálást, dúsítást alkalmazó módszerek . . . 236
Ultraszűrés . . . 236
Méretkizárásos kromatográfia (gélszűrés) . . . 236
Acetonitriles (ACN) kicsapás . . . 236
Perklórsavas (PCA) módszer . . . 236
Perklórsavas (PCA) kicsapás . . . 236
Mennyiségi mérések . . . 237
Perklórsavas (PCA) kicsapás kombinálása Western blot módszerrel . . . 237
Egyedi fehérjék kimutatása immunanalitikai módszerrel (immunoassay) . . . 238
Intracelluláris polipeptid kimutatása szövettenyészeti sejtekből . . . 239
Irodalom . . . 239
Sejtes elemek differenciálása: flow citometria - Bevezetés a flow citometriába . . . 240
(Magyarlaki Tamás)
Definíciók és célkitűzések . . . 240
Műszeres áttekintés . . . 240
Az egyes sejtek lézeres vizsgálata . . . 241
Multiparaméteres (többparaméteres) analízis perifériás vérsejteken (PBC) . . . 242
Fluoreszcencia . . . 243
Irodalom . . . 250
Autoimmun kórképek diagnosztikai lehetőségei (Berki Tímea) . . . 251
Az autoimmun betegségek jellemzői . . . 251
Az autoimmun betegségek típusai . . . 252
Az autoimmun betegségek diagnózisának kérdései . . . 253
Az autoantitest-meghatározás módszertana . . . 254
Antinukleáris autoantitestek a szisztémás kötőszöveti betegségek elkülönítésében . . . 254
Indirekt immunfluoreszcencia . . . 254
ANA ELISA-szűrőteszt (screen) . . . 255
ANA-immunoblot . . . 256
Multiplex autoantitest-meghatározási módszerek . . . 257
A laboratóriumi gyakorlatban mért autoantitestek . . . 259
Az autoimmun betegségekben elsősorban meghatározott autoantitestek . . . 259
A gyakorlatban vizsgált egyéb autoantitestek . . . 260
Szervspecifikus autoantitestek . . . 262
Irodalom . . . 265
A celluláris immunitás klinikai laboratóriumi vizsgálata (Berki Tímea) . . . 266
Morfológiai módszerek . . . 266
Áramlási citometria . . . 266
Mikroszkópos módszerek . . . 270
Citokinek kimutatása . . . 273
Az ELISPOT-módszer . . . 277
Irodalom . . . 278
A hemosztázis vizsgálatának újabb fehérjemódszertana (Tőkés-Füzesi Margit) . . . 279
A véralvadás folyamata . . . 279
Véralvadási tesztek . . . 282
Irodalom . . . 286
A thromboemboliás kórképek fehérjediagnosztikája (Tőkés-Füzesi Margit) . . . 287
D-dimer-meghatározás . . . 287
Thrombophiliák laboratóriumi diagnosztikája . . . 288
Antitrombin- (AT-) defektusok . . . 290
Protein C (PC-) defektusok . . . 290
Protein S (PS-) defektusok . . . 291
Aktivált Protein C (APC-) rezisztencia . . . 291
Protrombin 20210A polimorfizmus . . . 292
Antifoszfolipid-antitestek, lupus-antikoaguláns kimutatása . . . 292
Irodalom . . . 293
A testnedvek fehérje-összetételének diagnosztikus kémlelése . . . 294
A könny vizsgálata (Ludány Andrea) . . . 294
A könny fiziológiai szerepe és összetétele . . . 294
A könny fehérjéi . . . 294
A könnyfehérjék vizsgálata – klinikai diagnosztikai lehetőségek . . . 296
Szemészeti vonatkozások – a száraz szem szindróma . . . 296
A könnyfehérjék vizsgálata szisztémás betegségekben . . . 297
Ajánlott módszertani megközelítések a könny vizsgálatakor . . . 298
Irodalom . . . 300
A nyál fehérjéinek vizsgálata (Kőszegi Tamás) . . . 301
A nyál biológiai funkciói . . . 301
A nyál fehérje-összetétele . . . 301
A nyálfehérjék vizsgálati módszerei . . . 302
Funkcionális vizsgálatok . . . 303
Irodalom . . . 304
Vizeletvizsgálatok . . . 305
Vizeletvizsgálatok a proteinürítés tükrében (Ludány Andrea) . . . 305
Klinikai laboratóriumi analitikai módszerek . . . 305
Az emberi vizelet fehérjéi . . . 305
A fehérjék mennyiségi mérése . . . 305
A vizeletfehérjék megoszlási képének vizsgálata . . . 306
Vizeletfehérjék klinikai biokémiája és információs értékei . . . 308
Irodalom . . . 310
A proteinuria klinikai szempontjai (Wittmann István) . . . 311
Fogalmak, definíciók . . . 311
A proteinuria, microalbuminuria kialakulása . . . 311
A proteinuria, microalbuminuria előfordulása és jelentősége . . . 312
Az albuminuria meghatározása . . . 312
Meghatározás méretkizárásos kromatográfiával . . . 312
A proteinuria, microalbuminuria meghatározását befolyásoló tényezők . . . 312
Irodalom . . . 313
Száraz-kémiai fehérjekimutatások mint betegágy melletti gyorstesztek (POCT) - A POCT diagnosztikus értékei, a vizsgálatok hitelességének ellenőrzése (Liszt Ferenc) . . . 314
A betegellátás klinikai eredményességét javító POCT-gyakorlat lehetőségei a sürgősségi és intenzív terápiás ellátásban . . . 314
A POCT-gyakorlat kialakításának szakmai kérdései . . . 316
A POCT-gyakorlat minőségbiztosítása . . . 318
A POCT-diagnosztika hibaforrásai . . . 318
Rizikó-management a POCT területén . . . 318
A POCT-gyakorlat minőségirányítási rendszere . . . 318
Irodalom . . . 319
Fehérjék mint tumormarkerek az orvosi laboratóriumokban (Kőszegi Tamás) . . . 321
A tumormarkerek jellemzői . . . 321
A tumormarker definíciója . . . 321
Általános szempontok . . . 321
Peptid-fehérje tumormarkerek . . . 322
A fehérje természetű tumormarkerek extracelluláris térbe kerülésének mechanizmusa . . . 322
Tumormarkerek használata az orvosi gyakorlatban . . . 325
Irodalom . . . 327
Cardialis markerek laboratóriumi diagnosztikája és információs értéke a klinikumban (Ludány Andrea, Kőszegi Tamás) . . . 328
Az akut myocardialis infarctus diagnózisa . . . 328
Az akut coronaria-szindróma jelenlegi cardialis markerei . . . 328
A cardialis markerek szerepe az akut coronaria-szindróma terápiás döntéseiben . . . 332
Laboratóriumi medicina és a troponinok . . . 332
Cardialis markerek krónikus vesebetegségben és nem ischaemiás szívbetegségben . . . 333
Sürgősségi cardialis markerek . . . 334
Irodalom . . . 336
A liquorfehérjék újabb vizsgálati módjai (Komoly Sámuel) . . . 337
Irodalom . . . 340
A fehérjék mint neuroendokrin hormonok a klinikai laboratóriumi kutatásokban . . . 341
(Mezősi Emese, Kőszegi Tamás)
A neuroendokrin rendszer és hormonjai . . . 341
A neuroendokrin rendszer betegségei, a hormontermelés változásai . . . 342
A fehérje- és peptidhormonok meghatározásának klinikai jelentősége és nehézségei . . . 344
A peptidhormonok kutatásának eredményei . . . 345
Irodalom . . . 346
A csontanyagcsere fehérjemarkerei (Kőszegi Tamás) . . . 347
A csontrendszer . . . 347
A csontanyagcsere . . . 348
Osteoblastok által termelt faktorok . . . 348
Osteoclastok által termelt faktorok . . . 349
A csontanyagcsere endokrin szabályozása . . . 349
A leggyakoribb csontanyagcsere-betegségek . . . 350
Irodalom . . . 351
A metabolikus szindróma és a fehérjék (Wittmann István) . . . 353
A metabolikus szindróma definíciói . . . 353
A metabolikus szindróma előfordulása . . . 354
A metabolikus szindróma patogenezise . . . 354
Az inzulin szerepe . . . 354
Fehérjék az inzulin kivételével . . . 355
Obesitasban a zsírsejtek által termelt proteinek . . . 355
Egyéb hormonok . . . 357
Az inzulin intracelluláris jelátvitelében szerepet játszó proteinek és működésük
károsodása metabolikus szindrómában . . . 357
Irodalom . . . 359
A proteomika kutatási eredményei a jelen és a jövő klinikai laboratóriumában . . . 361
(Márk László)
Irodalom . . . 363
A daganatok epidemiológiai biomarkerei (Kiss István) . . . 364
Irodalom . . . 368
Tárgymutató . . . 369
A
A2M α
2-makroglobulin
AAT α
1-antitripszin
ABC avidin-biotin-peroxidáz komplex
ACC Amerikai Kardiológiai Kollégium
ACN acetonitril
ACR albumin-kreatinin hányados;
albumin-creatinin ratio
ACS akut coronaria szindróma
ACT α
1-antikimotripszin
ACTH adrenokortikotrop hormon;
corticotropin; adrenocorticotropic hormone
ADH antidiuretikus hormon
ADP adenozin-difoszfát
AF antinukleáris faktor
AFP α-fötoprotein
AGP savanyú glikoprotein
AIDS szerzett immunhiányos szindróma;
acquired immunodeficiency syndrome
AIH autoimmun hepatitis
α
1-AT α
1-antitripszin
AMI akut myocardialis infarctus
AMPK adenozin-monofoszfát-kináz
AMPPD dinátrium 3-(4-metilspiro-[1,2-dioxetán-3,2′-triciklo-[3.3.1.1]dekán]-4-il) fenilfoszfát
ANA antinukleáris antitest
ANCA antineutrofil citoplazma elleni antitest ANNA-1 antineuronalis nukleáris antigén 1
ANP A típusú natriuretikus peptid; atrialis natriuretikus peptid
AP alkalikus foszfatáz
APC antigénprezentáló sejt
APCI légköri nyomású kémiai ionizáció; atmospheric pressure chemical ionization APCI, APPI fotoionizáció
APS antifoszfolipid-szindróma
APTI aktivált parciális tromboplasztin idő
ARF ADP-ribozilációs faktor
ARIS Apoenzim Reaktivációs Immunoassay
ATCC American Type Culture Collection
ATP adenozin-trifoszfát; adenosine triphosphate
Rövidítések
B
BAP csontspecifikus alkalikus foszfatáz
BDGF csont eredetű növekedési faktor
BIPM Bureau International des Poids et Mesures
B
2M β
2-mikroglobulin
BMI testtömeg-index; body mass index
BMP bone morphogenetic protein
BNP B típusú natriuretikus peptid; brain natriuretic peptide; agyi natriuretikus peptid BPI bactericidal/permeability increasing protein
BSA marha-szérumalbumin; bovin serum albumin
C
CAH krónikus aktív hepatitis
CBB Coomassie Brilliant Blue
CCD charge-coupled device
CCP ciklikus citrullinált peptid, filaggrin
CD cluster of differentiation
CDR komplementaritást detektáló régió
CE kapilláris-elektroforézis; capillary electrophoresis
CEA carcinoembryonalis antigén
CEDIA Cloned Enzyme Donor Immunoassay
CER cöruloplazmin
CHCA, HCCA α-ciano-4-hidroxifahéjsav; α-cyano-4-hydroxycinnamic acid
CI kémiai ionizáció; chemical ionization
CID collision induced dissociation
CIDP krónikus inflammatiós demyelinisatiós neuropathia CIEEL kémiailag indukált elektroncserélő lumineszcencia
CK kreatin-kináz
CK-BB kreatin-kináz BB izoenzim (agy; brain)
CK-MB kreatin-kináz MB izoenzim (szív)
CK-MM kreatin-kináz MM izoenzim (izom; muscle)
CLIA Chemiluminescent Immunoassay
CMC kritikus micelláris koncentráció
CMIA kemilumineszcens mágneses immunoassay
CMV citomegalovírus
CNP C típusú natriuretikus peptid
CP cöruloplazmin
CRAB calcium, renal, anaemia, bone
CREST calcinosis, Raynaud-jelenség, oesophagusmotilitás zavara, sclerodactylia, teleangiectasia
CRMP5 Collapsin Response Mediator Protein
CRP C-reaktív protein
CT számítógépes rétegvizsgálat; komputer-tomográfia; computer tomography
CV variációs koefficiens
D
DAB diaminobenzidin
DCCT Diabetes Control and Complications Trial DELFIA késleltetett fluoreszcenciájú immunoassay
DHB 2,5-dihidroxi-benzoesav; 2,5-dihydroxybenzoic acid
DM diabetes mellitus
DMSO dimetil-szulfoxid
DNS dezoxiribonukleinsav; deoxyribonucleotic acid; DNA
DPD dezoxi-piridinolin
DPP-4 dipeptidil-peptidáz-4
dsDNS kétszálas DNS; double stranded DNA DTE ditioeritritrol
DTT ditiotreitol
E
EBV Epstein-Barr-vírus
ECL enhanced chemiluminescence
ECLIA elektrokemilumineszcenciás immunoassay
EDE párolgáson alapuló száraz szem; evaporative dry eye EDTA etilén-diamin-tetraecetsav; ethilenediaminetetraacetic acid EGF epidermalis növekedési faktor; epidermal growth factor EGTA etilénglikol-tetraacetát
EIA enzimimmunoassay
EIHIA Enzyme Inhibitory Homogeneous Immunoassay
EKG elektrokardiográfia
ELISA enzyme-linked-immuno-sorbent-assay ELISPOT enzyme-linked immunosorbent spot
EMIT enzyme-multiplied immunoassay technique
ENA extrahálható nukleáris antigének elleni autoantitestek eNOS endothelialis nitrogén-monoxid-szintáz
EPCA early prostate cancer antigen EPO erythropoietin
EQA external quality assessment; külső minőségellenőrzési rendszer ER endoplazmatikus retikulum; endoplasmic reticulum
ERK extracelluláris receptor-kináz
ESI elektroporlasztásos ionizáció; ElectroSpray Ionization ESI-MS elektrospray ionizációs mass spectrometry
ETD electron transfer dissociation
F
F
abfragment antigen binding
FAB gyors atombombázás; fast atom bombardment
FACS fluorescence activated cell electron transfer dissociation, ETD sorting
FAD flavin-adenin-dinukleotid; flavin adenine dinucleotide FBS foetal Bovine Somatotrophin)
F
cfragment crystallizable
FCM flow cytometry; áramlási citometria FD térdeszorpció
FGF fibroblast növekedési faktor; fibroblast growth factor FI térionizáció
FIA fluoreszcens immunoassay
FIB gyors ionbombázás; fast ion bombardment FITC fluoreszcein-izotiocianát
FL fluorescent scatter
FLC szabad könnyűlánc; free light chain FPIA fluoreszcenciapolarizációs immunoassay fPSA szabad (free) PSA
FRET fluoreszcenciarezonancia-energiatranszfer FSC forward scattered
FSH folliculusstimuláló hormon
G
GAPDH glicerinaldehid-foszfát-dehidrogenáz
GC-MS gázkromatográfiával kapcsolt tömegspektrometria; Gas Chromatography-Mass Spectrometry
G-CSF granulocyte-colony stimulating factor GDF9 growth differentiation factor-9
GFP green fluorescent protein
GIP glukózdependens inzulinotrop peptid GLP-1 glukagonszerű peptid-1
GLUT glukóztranszporter
GM-CSF granulocyte-macrophage colony stimulating factor
GOT glutamin-oxálecetsav-transzamináz; aszpartát-aminotranszferáz (AAT) GPC gyomor parietalis sejt
GPT glutamin-piroszőlősav-transzamináz
H
HAMA heterogén anti-mouse (antiegér) antitest
Hb hemoglobin
HbCO karboxihemoglobin
HBV hepatitis B vírus
HCCA, CHCA α-ciano-4-hidroxi-fahéjsav
HCDM Human Cell Differentiation Molecules
HCG, hCG humán koriogonadotropin
HCV hepatitis C vírus
HDGF hepatoma-derived growth factor
HDL high density lipoprotein
HE humán epididymisprotein
HEp-2 sejt Human Epithelioma Type 2 Cells HGF hepatocyte growth factor
hGH humán növekedési hormon; human growth hormone HIS kórházi számítógépes rendszer
HIV humán immundeficiencia-vírus HLB hidrofil/lipofil egyensúly (balansz)
HLDA Humán Leukocyta Differenciálódási Antigén Hp haptoglobin
HPLC nagy hatékonyságú folyadékkromatográfia; High Performance Liquid Chromatography HPT haptoglobin
HRP torma- (horseradish) peroxidáz HS CRP High-Sensitive CRP
HUVS hypocomplementaemiás-urticariás vasculitis szindróma HYDRAGEL agarózgél-elektroforézis
I
IA immunoassay
IDDM idiopathiás diabetes mellitus IDF Nemzetközi Diabetes Szövetség
ID-GCMS izotóphígításos gázkromatográfia/tömegspektrometria IE immunelektroforézis
IFCC International Federation of Clinical Chemistry and Laboratory Medicine IFE immunfixáció
IFG emelkedett éhgyomri vércukorszint; impaired fasting glucose IFN interferon
Ig immunglobulin
IGF inzulinszerű növekedési faktor; insulin-like growth factor IGT csökkent glukóztolerancia; impaired glucose tolerance IIF indirekt immunfluoreszcencia
IL-6 interleukin 6
ILAC International Laboratory Accreditation Cooperation IMA ischaemia okozta módosult albumin
IRS inzulinreceptor-szubsztrát ISD in source decay
IUIS International Union of Immunological Societies IVD in vitro diagnosztikum
IVDD In Vitro Diagnostical Directive; in vitro diagnosztikai irányelv IVF in vitro fertilizáció
J
JCA juvenilis krónikus arthritis
JCTLM Joint Committee on Traceability in Laboratory Medicine
K
KIR központi idegrendszer
KLH Keyhole Limpet Hemocyanin (limpet: kürtcsiga)
L
LC folyadékkromatográfia; fluid chromatography
LC-ESI folyadékkromatográfiás elektroporlasztásos ionizáció;
Liquid Chromatography Electron Spray Ionization
LC-ESI-MS folyadékkromatográfiás elektroporlasztásos tömegspektrométer;
Liquid Chromatography Electron Spray Ionization Mass Spectrometry LCM lézer-disszekció; laser capture microdissection
LC-MS/MS folyadékkromatográfiával kapcsolt tandem tömegspektrometria (Liquid Chromatography-Tandem Mass Spectrometry
LDI lézerdeszorpciós ionizáció LDL low density lipoprotein LGL large granular lymphocyte
LH luteinizáló hormon
1
LIF lézerindukált fluoreszcencia
2
LIF leukaemiainhibitor faktor
LIR laboratóriumi informatikai rendszer
LIS laboratóriumi számítógépes rendszer
LKM máj-vese mikroszóma; liver-kidney microsomal LSIMS folyadék szekunderion tömegspektrometria
M
MALDI mátrix segített lézerdeszorpciós ionizáció; Matrix-Assisted Laser Desorption/
Ionization
MALDI-MS mátrixszal segített lézer-deszorpciós-ionizációs mass spectrometry
MALDI-TOF mátrixszal segített lézer-deszorpciós-ionizációs repülési idő tömegspektrometria MALDI-TOF MS mátrix segítette lézerdeszorpciós ionizációt alkalmazó repülési idő
tömegspektrometria; Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry
MAPK mitogén aktiválta protein-kináz MB microbead; mikrogyöngy
MBS m-maleimidobenzil-N-hidroxiszukcinimid-észter MCP monocyta kemoattraktáns protein
MCTD kevert kötőszöveti betegség; mixed connective tissue disease
MEIA Microparticle Enzyme Immunoassay
MetHb methemoglobin
MFI mean fluorescent intensity; átlag fluoreszcencia
MGUS monoklonális gammopathia nem meghatározott jelentőséggel;
monoclonal gammopathies with undetermined significance
MHC major histocompatibility complex
MIF migrációt gátló faktor miRNS mikro-RNS
MPGN membranoproliferativ glomerulonephritis MPO mieloperoxidáz
MR mágneses rezonancia képalkotás
mRNS hírnök RNS; messenger RNS
MS tömegspektrometria; mass spectrometry MSH melanocytastimuláló hormon
mTOR mammalian target of rapamycin
MUP 4-metil-umbelliferon-foszfát
N
NACB National Academy of Clinical Biochemistry NAD
+oxidált nikotinamid-adenin-dinukleotid NADH redukált nikotinamid-adenin-dinukleotid
NADP nikotinamid-adenin-dinukleotid-foszfát; nicotinamide adenine dinucleotide phosphate NDAS nem differenciált autoimmun betegség
NDC nem differenciált collagenosis NGF nerve growth factor
NGSP National Glycohemoglobin Standardization Program
NHS N-hidroxiszukcinimid
NO nitrogén-monoxid
NSE neuronspecifikus enoláz
NSTD Non-Sjögren Tear Deficient Dry Eye
NSTEMI non-ST-szegment emelkedés myocardialis infarctus NT-pro BNP N-terminális pro-B típusú natriuretikus peptid
O
OGP oligoklonális gammopathia
P
PACAP adenilát-cikláz-aktiváló polipeptid PAG poliakrilamidgél
PAGE poliakrilamid-gélelektroforézis
1
PAP peroxidáz-antiperoxidáz
2
PAP prostata savi foszfatáz
1
PBC primer biliaris cirrhosis
2
PBC vérsejtek
PBS pufferolt sóoldat PCA perklórsav
PCR polimeráz-láncreakció; Polymerase Chain Reaction
PD plazmadeszorpció
PDGF thrombocyta eredetű növekedési faktor; platelet-derived growth factor PDK foszfoinozitiddependens protein-kináz
PE fikoeritrin
PerCP peridinin-klorofill-protein
PHA fitohemagglutinin
PI protrombinidő
PIGF placental growth factor PKC protein-kináz C
PMA forbol-12-mirisztát-13-acetát PMF Peptide Mass Fingerprinting PMSF fenil-metil-szulfonil-fluorid POC point-of-care
POCT point of care testing; point-of-care test PPO difeniloxazol
PSA prostataspecifikus antigén PSC primer sclerotizáló cholangitis PSS progresszív szisztémás sclerosis PSD post source decay
PTC procalcitonin
PTH parathormon
PYD piridinolin
Q
QC quality control
R
RA rheumatoid arthritis
RAAS renin-angiotenzin-aldoszteron rendszer RANKL receptor aktivált nukleáris faktor k-B ligand
RES reticuloendothelialis systema; reticuloendothelialis rendszer; monocyta-macrophag rendszer
RF rheumatoid faktor RIA radioimmunoassay
RNP ribonucleoprotein (particle)
RNS ribonukleinsav; ribonucleotic acid; RNA rRNS riboszóma RNS
S
SA mustársav
SDS nátrium-dodecil-szulfát; Sodium Dodecyl Sulphate
SELDI-MS felület segítette lézerdeszorpciós/ionizációs tömegspektrometria; Laser Desorption
Ionization Mass Spectrometry
SI Système International d’Unités; Mértékegységek Nemzetközi Rendszere SIMS szekunder ion tömegspektrometria
siRNS short interfering RNA
SLE szisztémás lupus erythematosus
SLFIA Substrat-Labeled Fluorescent Immunoassay
SMA simaizom elleni antitestek; smooth muscle antibodies snuRNS mag-RNS
SOD szuperoxid-dizmutáz
SPDE szilárd fázisú dinamikus extrakció; Solid Phase Dynamic Extraction SPE szérumfehérje elektroforézis
srpRNS mag-RNS
SS Sjögren-szindróma SSC side scatter
STEMI ST szegment emelkedéssel járó akut myocardialis infarctus
T
TAG tumorasszociált glikoprotein
TAT turn around time; leletátfordulási idő TBP tributilfoszfin
TBS TRIS pufferolt sóoldat TCA triklórecetsav
TDDE kis könnytartalmon alapuló száraz szem; tear-deficient dry eye TEMED N,N,N,N-tetra-metilén-diamin
Tg tireoglobulin
TGF-
atransforming growth factor alpha
TGF-b transzformáló növekedési faktor-β; transforming growth factor beta TK timidin-kináz
TNF-a tumour necrosis factor alpha TnC troponin C
TnI troponin I TnT troponin T
TOF repülési idő (analizátor); time-of-flight TPA tripropilamin
TPA szöveti (tissue) polipeptid-antigén
1
TPO thrombopoietin
2
TPO pajzsmirigy-peroxidáz tPSA total PSA
TRAP tartarátrezisztens savanyú foszfatáz TRF transzferrin
TRH tireotrop releasing hormon TRITC tetrametil-rodamin-izotiocianát tRNS szállító RNS; transzfer RNS TSH thyroideastimuláló hormon
TSPA könnyspecifikus prealbumin; tearspecific prealbumin
tTG szöveti transzglutamináz
U
UAER vizelet-albuminürítés
UCTD nem differenciált kötőszöveti betegség
UPE vizeletfehérje elektroforézis; urine protein electrophoresis UPI vizeletfehérje immunfixáció; urine protein immunofixation
UPLC igen nagy hatékonyságú folyadékkromatográfia; Ultra Performance Liquid Chromatography
UPLC-MS/MS ultrahatékonyságú folyadékkromatográfiás tandem tömegspektrometria;
Ultra Performance Liquid Chromatography Tandem Mass Spectrometry UPR unfolded protein response
UV ultraibolya; ultraviolet
V
VEGF vascular endothelial growth factor VLDL very high density lipoprotein
W
WHO World Health Organization, Nemzetközi Egészségügyi Világszervezet
A fehérje mint az élet princípiuma
Az élő rendszernek inherens módon egységnek kell lennie, és biológiai anyagcserét kell folytatnia. Ez nem pusztán anyagok felvételét és leadását, valamint átala- kítását jelenti, hanem azt is, hogy eközben a szerve- zet saját anyagait a rá jellemző arányokban, időben és térben előállítja, sőt akár gyarapíthatja is, miközben az anyagátalakítások kémiai energiával is ellátják. Az anyagátalakítások során a rendszer azokat az infor- mációkat is forgalmazza, amelyek a szabályozásához és önszerveződéséhez szükségesek. A sajátos módon szervezett biokémiai reakcióhálózatok egyes vagy so- rozatos reakciói katalizáltak és szabályozottak. Az élő rendszernek stabilisnak kell lennie; vagyis reagálni kell tudnia környezetének ingereire, de ezenközben nem vesztheti el önazonosságát (a homeosztázis fo- lyamata). Az élő rendszernek rendelkeznie kell olyan alrendszerekkel, amelyek a teljes rendszer keletkezé- se, létezése és működései számára hordoznak infor- mációkat. Ilyen az örökletes információt hordozó genetikai állomány, a sejtek közötti kommunikáció rendszere (főleg a hormonális és az idegrendszer), to- vábbá a sajátot az idegentől megkülönböztető önvédő rendszer (immunrendszer). Ez összetett feladatrend- szer ellátásának egyik titka a fehérjékben rejlik.
A fehérje (protein) kifejezés a görög „protosz”
szóból ered, jelentése az „első” az elemek közt. A fe- hérjék az élő szervezetet felépítő biomolekulák egyik meghatározó csoportját alkotják. Szerkezetükben az unikális és az univerzális elemek sajátos egyensúlya valósul meg. Így amellett, hogy pl. egyedi enzim- funkciókat látnak el, számos közös tulajdonsággal is rendelkeznek. A fehérjék valamennyi élő sejt számára az optimális szerkezet, a jó funkció, a növekedés, a működési zavarok helyreállításának elengedhetetlen eszközei. Fontos biológiai szerepüket jellemzi, hogy minden sejtben lejátszódó folyamatban részt vesz- nek. Számos fehérje enzimaktivitást mutat, azaz vala- milyen biokémiai folyamat katalizátoraként segíti elő a sejt életben maradását. Fehérjék rendelkezhetnek
stabilizáló, szerkezeti funkcióval is. Ilyen a sejt alakjá- nak kialakítása (aktin, mikrotubuláris sejtváz, inter- medier filamentum), sejten belüli transzportfolyama- tok lebonyolítása (dinein, kinezin, miozin), mozgatás (aktomiozin rendszer). Más fehérjék a sejt és környe- zete közötti információáramlás megvalósítása révén teszik lehetővé, hogy a sejt érzékelni tudja a külvilág ingereit és reagálni tudjon rájuk. Összegezve, a fehér- jék az élet nélkülözhetetlen tényezői.
A molekuláris biológia központi tétele a genetikai információ áramlását az élő szervezetekben a DNS-től az RNS-en keresztül a fehérjékig határozza meg. A legújabb technikák már alkalmasak arra, hogy az e biomolekulák közötti sokféle kölcsönhatásról és a ge- netikai információáramlás minden egyes lépcsőfoká- ról, az azokat befolyásoló specifikus körülményekről, így a környezeti hatásokról és a stresszállapotokról információt szerezzünk. Közülük megemlíthetjük a genomikát, a transzkriptomikát, a proteomikát, vala- mint a glikomikát és a metabolomikát.
A fehérjék szerkezete, kémiai tulajdonságai
A fehérjék szerkezete és kémiája. A fehérjék amino- savak lineáris polimerjeiből felépülő szerves mak- romolekulák. Aminosavsorrendjüket a gének nuk- leotidszekvenciája kódolja a genetikai kódszótárnak megfelelően. Kialakításukban 20 féle „proteinogén”
(fehérjealkotó) aminosav vesz részt, melyek az ami- no- és karboxilcsoportjaik között kialakuló peptid- kötés révén kapcsolódnak egymáshoz. Egyes poli- peptidek kialakításában több ezer aminosav is részt vehet, míg azokat, melyek kevesebb (<50) amino- savból épülnek fel, peptideknek szokás nevezni, bár a peptid–fehérje megkülönböztetést elég lazán kezeli a tudományos nómenklatúra. A funkcióképesség meg- szerzéséhez vagy a megfelelő szabályozás érdekében gyakran találkozunk az aminosav oldalláncainak utólagos (poszttranszlációs) módosításával. A leg- gyakoribb módosítás a foszforiláció, melynek során a
1. Bevezetés
Kovács L. Gábor
fehérjére specifikus kináz enzim foszfátcsoportot he- lyez egy meghatározott Ser, Thr, Tyr, ritkábban His oldalláncra. A glikoziláció szintén gyakori jelenség, ebben az esetben oligoszacharid/monoszacharid lán- cok kapcsolódnak Asn, Ser, Thr láncokhoz. Az amid- és aminocsoportot tartalmazó aminosav-oldalláncok között, transzglutamináz-reakció eredményeként, ki- alakulhatnak peptidkötést tartalmazó kereszthidak, mint pl. véralvadás vagy a tej megalvadása során.
Az elsődleges vagy primer szerkezet a fehérje ami- nosavszekvenciája. A fehérjelánc szintézisekor a leg- utoljára beépült aminosav karboxilcsoportjához kap- csolódik a következő aminosav aminocsoportja és így tovább. Így megkülönböztetjük a fehérjelánc „elejét”, a szabad aminocsoportot tartalmazó N-terminálist, valamint a „végét”, a szabad karboxilcsoportot tartal- mazó C-terminálist.
A másodlagos vagy szekunder szerkezeten a pep- tidgerinc hidrogénkötések által stabilizált lokális (legalább négy aminosavra kiterjedő) rendezettsé- gét értjük. Ezt a szerkezeti szintet a peptidsíkok egy- máshoz képest történő elfordulásával jellemezhetjük.
E szerkezeti elemek legfőbb csoportjai a jobb- vagy balmenetes hélixek, a redők, a hurkok és a kanyarok;
leggyakoribb az α-hélix, az antiparallel β-redő és a β-kanyar.
A harmadlagos vagy tercier szerkezet egy polipep- tidlánc teljes térbeli konformációja. Ezt a konformá- ciót mindenekelőtt a hidrofób kölcsönhatások stabi- lizálják. Egy peptidlánc tartalmazhat egyetlen vagy többféle másodlagos szerkezeti elemet, melyek ren- dezetlen szakaszokkal váltakoznak, de ismertek olyan fehérjék is, melyekből teljesen hiányoznak a rendezett szerkezetek, ezeket natívan rendezetlen fehérjéknek nevezzük.
Bizonyos fehérjéket több peptidlánc alkot, melye- ket ez esetben alegységeknek nevezünk (negyedleges szerkezet). A peptidláncok lehetnek azonosak vagy el- térőek, számuk általában nem haladja meg a nyolcat, de ismertek fontos kivételek: pl. egyes vírusok kap- szidja hatvan polipeptidből is állhat.
Egyszerű és összetett fehérjék. A fehérjéket osztá- lyozhatjuk összetételük alapján. Az egyszerű fehérjé- ket csak aminosavak építik fel, hidrolízisükkor csak aminosavak képződnek. Az összetett fehérjék hidro- lizátuma egyéb alkotórészt is tartalmaz. Így lehet-
nek metalloproteinek (fémionokat tartalmaznak, pl.
az alkohol-dehidrogenáz Zn2+-t, a citokróm-oxidáz Cu2+-t), foszfoproteinek (pl. kazein), hemproteinek (pl. hemoglobin, mioglobin, citokróm-c), glikopro- teinek (szénhidrátrészt tartalmaznak, pl. γ-globulin), lipoproteinek (pl. β1-lipoprotein), flavoproteinek (pl. a szukcinát-dehidrogenáz) vagy nukleoproteinek (nuk- leinsavakat tartalmaznak, pl. a dohánymozaik-vírus és az atelomeráz enzim).
A fehérjék osztályozása funkciójuk alapján. A fe- hérjék sokféle funkciót töltenek be a szervezetben, ezek közül a fontosabbak: enzimek (pl. tripszin, cito- króm-c), transzportfehérjék (hemoglobin, hemocia- nin, szérumalbumin), védőfehérjék (lehetővé teszik, hogy a szervezet fertőzéssel vagy sérüléssel szemben védekezzék, pl. ellenanyagok, fibrinogén, trombin), toxinok (pl. kígyómérgek), hormonok (pl. inzulin, mellékvesekéreg-serkentő hormon: ACTH, növeke- dési hormon), struktúrfehérjék (a mozgáshoz szilárd vázat biztosítanak, és a külső védelmet szolgálják, pl.
kollagén, elasztin, retikulin), motorfehérjék (a sejt- szervecskék, vezikulumok sejten belüli mozgatása a feladatuk, pl. aktin, miozin, kinezin, dinein), vala- mint tartalékfehérjék (az embrionális fejlődés zálo- gai, pl. ovalbumin).
Fehérjék az élő sejtben
A fehérjék szintézise. A sejt DNS-állományában bá- zispár-kombinációk formájában tárolt információ tulajdonképpen a 20 féle aminosav valamelyikét kó- dolja, 3 bázispáros szavakban. Egy-egy gén egy fehér- je tervrajzát tartalmazza. A transzkripció során ez a leírás egy közti molekula (mRNS) formájában mobi- lizálódik, és a genomból a fehérjeszintézist végző ri- boszómákhoz kerül, amelyek az mRNS-t tervrajzként használva legyártják a fehérjéket, az aminosavakat egyenként egymás mögé kapcsolva. A transzkripció helye a sejt DNS-állományához kötött eukarióták vagy valódi sejtmagosokban a sejtmag, a prokarióták, vagy sejtmagnélküliekben a citoplazma.
Transzkripció. Az RNS-szintézist az RNS-polimeráz nevű enzim katalizálja („alternatív splicing”). A szin- tézis kezdetén a DNS kettős hélix szerkezete felnyí-
lik. Az RNS-polimeráz a DNS ún. értelmes szálához kapcsolódik, és megkezdi annak átírását. Ez az átírás a bázispárképzés szabályainak megfelelően megy végbe. A bázisok beépítéséhez ATP eredetű energia szükséges. A szintézis végén az RNS-molekula leválik a DNS-ről, és visszaáll a kettős hélix szerkezet. Ezután eukariótákban az mRNS a sejtmaghártya pórusain át a citoplazmába transzportálódik, prokariótáknál viszont már a transzkripció alatt úgynevezett ribo- szómák kapcsolódnak az mRNS-hez, és megkezdik a fehérjék előállítását. Egy-egy mRNS-hez egyszerre több riboszóma is kapcsolódhat, ami meggyorsítja a fehérjeszintézis folyamatát. Ezeket a képződményeket poliriboszómáknak nevezzük.
Aminosavak aktiválása. Az aminosavak aktiválá- sa energiaigényes, a szükséges mennyiséget az ATP hidrolízise fedezi. Az aminosavak aminosavaktivá- ló enzimhez kapcsolódnak, mely kapcsolatba lép a tRNS-molekulával, végül az aminosav kapcsolódik a tRNS aminosavkötő helyére.
Transzláció. A riboszóma kisebbik alegysége kapcso- lódik az mRNS 5’ végéhez, majd ezután kapcsolódik a riboszóma nagyobbik alegysége is. A transzláció során a riboszóma (multienzim-komplex) határoz- za meg a szintézisben részt vevő molekulák térbeli elrendeződését, együtt tartja az mRNS-t és a növek- vő polipeptidláncot, és a szintézis előrehaladásával folyamatosan továbblép az mRNS-en. A transzlá- ció apparátusa a polipeptid képzésekor az mRNS-en 5’–3' irányban halad. Minden egyes aminosavnak 3-3 nukleotidból álló kodonja sorakozik egymás után az mRNS-en, amelyek a tRNS-eken található 3-3 komp- lementer nukleotidból álló antikodonnal párosod- nak.
A transzláció első lépéseként az első aminosavat (a lánckezdő metionint) szállító tRNS kapcsolódik a riboszóma P- (peptidkötő) helyéhez, a következő aminosavat szállító tRNS pedig az A- (aminosav- kötő) helyéhez. A P-helyen lévő metionin (majd ké- sőbb a polipeptid) és az A-helyre szállított aminosav között ATP-energia felhasználásával és enzimek se- gítségével peptidkötés alakul ki, ezután a kialakított peptidszakasz továbbítódik a peptid-kötőhelyre, a beépült aminosavat szállító tRNS szabadon leválik, a riboszóma továbblép az mRNS-en. A megfelelő ko-
don felismerése után az aminoacil-tRNS-ek egymás után kapcsolódnak a riboszómához, adják le az ami- nosavakat és így hosszabbítják a polipeptidláncot. A növekvő polipeptidlánc a riboszóma kis alegységéhez kapcsolódik.
A polipeptidlánc szintézisének végét az úgy- nevezett „stop”-kodonok határozzák meg. Három lánczáró kodon létezik: UAA, UGA, UAG. A ter- minációs kodonhoz egy release-faktor kapcsolódik (peptidil-transzferáz), amely képes a P-helyen lévő utolsó tRNS és aminosav közötti kötés hidrolízisére.
Ezután a tRNS és a polipeptid távozik, majd megszű- nik a riboszóma és az mRNS közötti kapcsolat, végül a riboszóma alegységeire hidrolizál.
A fehérjék felgombolyodása (folding). A fehérje gombolyodásának problémája, hogy a frissen szin- tetizált polipeptidlánc hogyan jut el abba a három- dimenziós szerkezetbe, amely biztosítja a biológiai rendszerben neki szánt funkció teljesítését. Bizonyos konformációs betegségekben félig felgombolyodott fehérjék vízben oldhatatlan aggregátumai rakódnak le a szövetekben. Az irodalomban publikált felgom- bolyodási vizsgálatok valójában az újragombolyodást (refoldingot) tanulmányozták. A fehérjefelgombo- lyodás kísérleti tanulmányozására használt általános módszer a kémiai ágensekkel való denaturáció és az ezt követő hirtelen kihígítás, aminek következménye- ként a denaturáló kémiai ágens koncentrációja a kri- tikus alá csökken, így megindul a felgombolyodás. (A nyomás-denaturáció olyan új eszközt kínált, amellyel a kémiai ágenst kiválthattuk.)
A fehérjefelgombolyodási vizsgálatok egyik fon- tos kérdése a feltekeredési útvonalon létrejövő köz- tes állapotok létezése volt. Számos kísérletet, ill. mo- dellszámolást végeztek ugyanis annak bizonyítására, hogy a fehérjék feltekeredésük során köztes állapoto- kon mehetnek keresztül.
Posztszintetikus módosítások. A polipeptidlánc a szintézis lezárultával további átalakulásokon megy keresztül. Ilyen átalakulás során kialakul a fehérje másodlagos szerkezete, az első (metionin) vagy első néhány aminosavat enzimek eltávolíthatják, vagy a láncot elvághatják, vagy különböző funkciós csopor- tok kapcsolódhatnak a lánchoz (foszfátok, lipidek, szénhidrátok).
A fehérjék lebomlása. A fehérjelebontás, az amino- savátalakulás különösen az emlősök szervezetében igen nagy jelentőségű. A táplálékkal felvett fehérjé- ket hidrolitikus enzimek első lépésben aminosavakra bontják. A peptidkötést bontó enzimek a proteázok.
Az aminosavak aztán különféle átalakulási folya- matokban vehetnek részt, pl. az extracelluláris tér- ből aktív transzporttal a sejtbe jutó aminosavak fel- használódnak fehérjék, peptidek bioszintéziséhez; az aminosavak részt vesznek egyéb nitrogéntartalmú vegyületek bioszintézisében (koenzimek, purin- és pirimidinvázas vegyületek, hormonok); dekarboxi- lezéssel biogén aminok keletkeznek; az aminocso- port lehasadása után szénláncuk a lipid- és szén- hidrát-anyagcserefolyamatokba kapcsolódhat be (a citrátkörön keresztül); a sejtek ketosavaiból transz- aminálással más aminosavak keletkeznek; az amino- savak egymásba alakulásukkal endogén aminosavak (nem esszenciális) szintézisében is részt vehetnek, ill.
a lehasadó ammónia és szén-dioxid karbamiddá ala- kulva kiürül a szervezetből.
Az aminosavak dezaminálása. A legtöbb dezaminá- lás transzaminálási reakcióban valósul meg. Az ezt katalizáló enzim aktív centrumában piridoxál-fosz- fát (a B6-vitamin származéka) van. Ennek aldehid- csoportja képes kapcsolatot létesíteni az aminosav aminocsoportjával. Ez víz hatására elbomlik, és ke- tosav lép ki a komplexből, míg az aktív centrumban piridox amin-foszfát marad vissza.
Oxidatív dezaminálás során ammónia keletkezik.
A glutaminsav oxidatív dezaminálását katalizáló de- hidrogenáz enzim jelentős szerepet játszik a folya- matban. Az aminocsoport eltávolításakor a NAD+ koenzim redukálódik, és egy könnyen hidrolizálódó iminosav köztiterméken keresztül α-keto-glutársav és ammónia képződik. Az ammónia karbamid for- májában ürül ki a szervezetből.
Nem oxidatív dezaminálás során az ammónia mellett kettős kötést tartalmazó termék is létrejön.
A dezaminálás során képződő szénlánc főként a cit- rátkörön keresztül alakul széndioxiddá és vízzé. Az
aminosavak hét fő intermedier molekulává (piruvát, α-keto-glutársav, szukcinil-KoA, fumársav, oxálecet- sav, acetil-KoA, acetoacetát) bomlanak le.
Az aminosavak dekarboxilezése. Az aminosavak a széndioxid kilépése után a megfelelő aminokká ala- kulnak. Az aminokat biogén aminoknak nevezzük, mert számos képviselőjük fontos biológiai funkciókat tölt be. Az aminosavak dekarboxilezését specifikus, piridoxál-5-foszfát koenzimmel működő dekarboxi- láz enzim végzi. A hisztamin hisztidinből, a tiramin tirozinból, a triptamin triptofánból, a kadaverin a li- zinből keletkezik dekarboxilezéssel. A glutaminsav- ból γ-amino-vajsav jön létre.
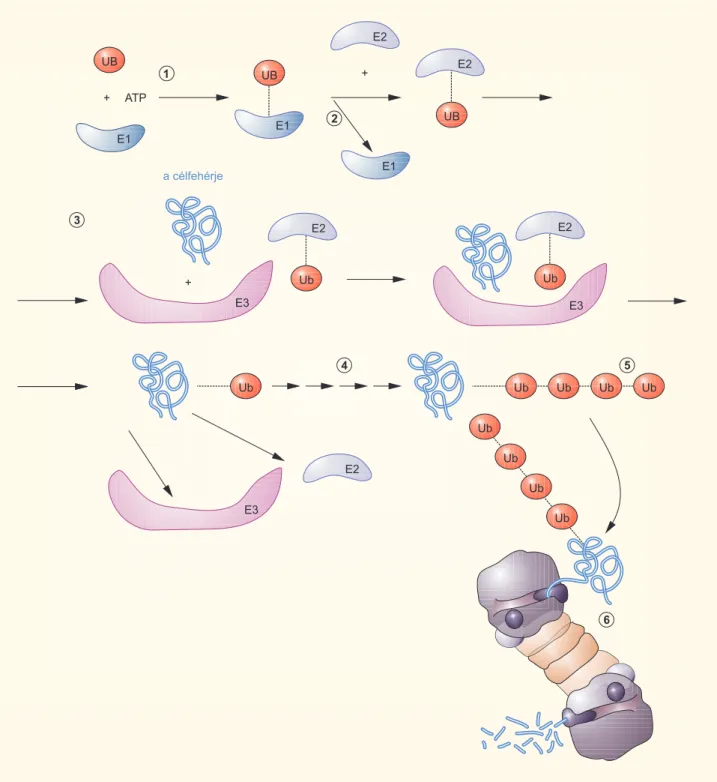
Az ubikvitinrendszer. Miközben a fehérjékkel kap- csolatos kutatások nagy része azzal foglalkozott, va- jon hogyan jöhetnek létre a proteinek, addig a ma- gyar származású Avram Hershko, a haifai Technion – Israel Institute of Technology munkatársa első ku- tatásai óta a lebomlás iránt érdeklődik. A fehérjék le- bontásáról sokáig nem sok ismeretünk volt, néhány egyszerű proteinlebontó enzimről tudtunk mindösz- sze. Ilyen pl. a tripszin, mely a vékonybélben bontja le az elfogyasztott ételekből származó fehérjéket. Ma már tudjuk, hogy a sejtek az ubikvitinrendszeren ke- resztül bontják le hibás fehérjéiket. Az újonnan lét- rejött proteinek 30%-a végzi a proteaszóma megsem- misítő gépezetében, ha nem jutnak keresztül a sejt szigorú ellenőrző rendszerén. Az ubikvitinrendszer hibás működése számos betegséghez, pl. rákhoz ve- zet. A szisztéma megismerésének orvosi jelentősége, hogy (többek között) bizonyos daganatos, immun-, idegrendszeri betegségek gyógyíthatók lennének, ha csak a káros fehérjék jelölődnének és bomlanának le.
A Nobel-díjas eredmények ahhoz is hozzájárultak, hogy jobban megértsük az immunrendszer műkö- dését. Ezekkel az új ismeretekkel lehetővé vált annak megértése is, hogy a sejtek molekuláris szinten mi- ként kontrollálnak számos fontos biokémiai folyama- tot, mint pl. a sejtciklust, a DNS-újratermelést és a génmásolást (1-1. ábra).
1-1. ábra. Fehérjék lebomlása – az ubikvitin (UB) szerepe 1. Az E1 enzim aktiválja az ubikvitinmolekulát
2. Az E1 enzim átadja az ubikvitinmolekulát az E2 enzimnek 3. Az E3 enzim már képes felismerni a lebontandó fehérjét 4. Az E2 enzim közel kerül a fehérjéhez, és átadja az ubikvitint 5. Ez többször is megismétlődik, így ubikvitinlánc alakul ki
6. A proteaszóma felismeri az ubikvitinláncot, és feldarabolja a fehérjét
A fehérjék kölcsönhatásai
A fehérjék szerkezetét fenntartó kölcsönhatások alap- vetően négy nagyobb csoportba oszthatók:
• Elektrosztatikus kölcsönhatások.
• Diszperziós erők.
• H-hidak.
• Hidrofób kölcsönhatások.
Mai értelmezésünk szerint a komplex biológiai rend- szerek, pl. egy sejt alkotóelemei, sokrétű bonyolult és dinamikus kölcsönhatásban vannak egymással, és ezek a kölcsönhatások elektromágneses természe- tűek, elsősorban Coulomb-erőkre vezethetőek vissza.
A fehérjék mindig vizes közegben működnek, és ma- guk is jelentős mennyiségű (20–70%), felszínükön és üregeikben kötött vizet tartalmaznak. E hidrátburok
vízmolekulái integráns részét képezik a térszerkezet- nek, és elengedhetetlenek a működéshez. A fehérjék különleges képessége, szerkezeti és funkcionális sok- oldalúsága elsősorban annak tulajdonítható, hogy szemben a szilárd anyagokkal, amelyeket főként erős kovalens és ionos kötések tartanak egyben, és a folya- dékokkal, amelyeknek részecskéi között gyenge má- sodlagos kötések hatnak, a fehérjékben e két kötés- típus kombinációjával találkozunk. Az aminosavak oldatát a sejt fehérjéitől az különbözteti meg, hogy a sejt működési körülményei között az aminosavak kovalens kötéssel, adott sorrendben láncba vannak rendezve. Ez a polipeptidlánc korlátozott flexibili- tással rendelkezik, ami lehetővé teszi a térbeli gom- bolyodást, felcsavarodást, a lánc nem szomszédos oldalláncainak közelkerülését. A nem-kovalens kö- tések közeli molekulák és molekularészletek közöt-
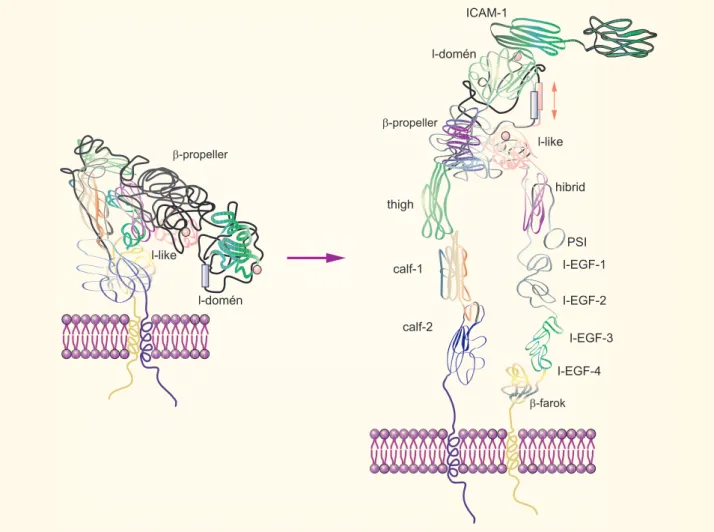
1-2. ábra. Sejt-sejt kapcsolatot kialakító fehérjék (pl. integrinek) aktiválódása során jellegzetes makroszkopikus szerkezet- változás következik be
(Rövidítések – EGF: epidermalis növekedési faktor; I: integrin; ICAM: intercelluláris adhéziós molekula)